HALOGÈNES
Article modifié le
Dérivés halogénés
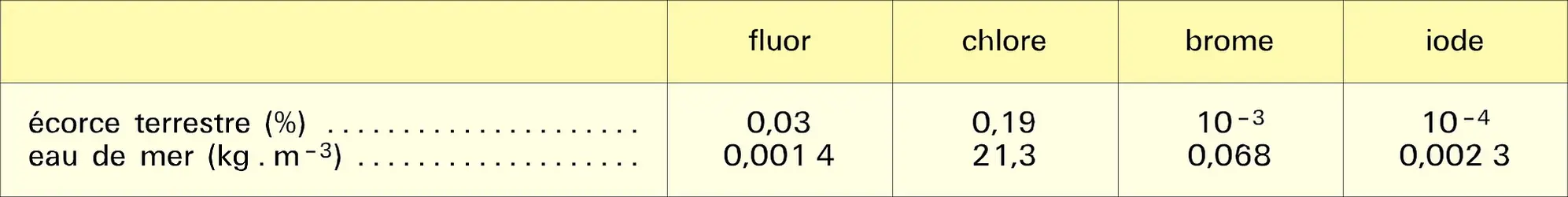
Les dérivés halogénés résultent du remplacement, par des halogènes F, Cl, Br, I, d'un ou de plusieurs atomes d'hydrogène des hydrocarbures. Ils se rencontrent rarement à l'état naturel : présence d'iode dans la tyroxine, présence de chlore dans l'antibiotique chloromycétine. Le brome, en revanche, existe dans un certain nombre d'organismes marins : le dibromo-6,6′-indigo extrait de certains mollusques et qui était la base de la pourpre des anciens, la bromo-2-leptoclinidinone extraite d'organismes marins et qui possède des propriétés antitumorales. Il en existe une très grande variété dont la réactivité diffère notablement selon qu'ils sont saturés ou non, aliphatiques ou aromatiques, mono- ou polyhalogénés ; les dérivés fluorés ont un comportement particulier. Leur nomenclature les désigne par le nom de l'hydrocarbure précédé du préfixe halogéno (fluoro, chloro, bromo, iodo) complété par l'indication de la position occupée par l'halogène. Ils sont couramment dénommés halogénures d'alkyle, d'alcényle, d'aryle.
Préparations
Le dichlore réagit avec les alcanes par un mécanisme radicalaire peu sélectif. On obtient des mélanges d'isomères ainsi que des dérivés polychlorés. Industriellement, le méthane est chloré thermiquement en mono-, di-, tri- et tétrachlorométhane ; les proportions des quatre dérivés formés dépendent du rapport Cl2/CH4.
Le tétrachlorométhane est obtenu par chloration à température élevée d'un mélange de propane et de propène ; il se forme une quantité équivalente de tétrachloroéthylène (perchloroéthylène) ; on l'obtient également par chloration du disulfure de carbone sur catalyseur au fer.
L'addition des acides halogénés (HCl, HBr) sur les alcènes conduit aux dérivés monohalogénés : l'addition est trans, sa régiosélectivité conforme à la règle de Markovnikov (X– se fixe au niveau de l’atome de carbone le plus substitué, où la densité de charge positive du cation est maximale) et la réactivité décroît de HI à HCl. Dans le cas de HBr, l'addition, réalisée en présence de lumière ou d'un initiateur de réaction radicalaire, conduit au produit anti-Markovnikov :
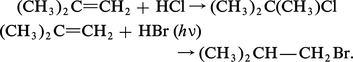
La méthode la plus générale de préparation des halogénures d'alkyle est l'action des acides halogénés sur les alcools. La réaction est d'autant plus aisée que le réactif halogénure est plus nucléophile, d'où l'ordre de réactivité : HI > HBr > HCl > HF. Compte tenu des mécanismes différents, la vitesse de réaction décroît dans l'ordre des alcools : tertiaire ⪢ secondaire > primaire. Pratiquement irréversible dans le cas des alcools tertiaires, la transformation est équilibrée pour les autres alcools et est rendue complète en éliminant l'un des produits formés.
L'acide chlorhydrique HCl est activé par un catalyseur comme le chlorure de zinc ZnCl2 qui le transforme en superacide ZnCl–3, H+.
Divers halogénures d'acides minéraux sont également mis en œuvre avec les alcools : les dérivés chlorés sont préparés à partir du chlorure de thionyle SOCl2, du trichlorure PCl3 et de l'oxychlorure POCl3 de phosphore et les dérivés bromés à partir du tribromure de phosphore PBr3 :
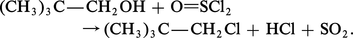
Les dérivés bromés et iodés peuvent être préparés par décarboxylation du sel d'argent ou de mercure d'un acide carboxylique sous l'action de l'halogène Br2 ou I2 (réaction de Hunsdiecker).
Les dérivés fluorés et iodés peuvent également s'obtenir par échange d'halogène : un chlorure d'alkyle en solution acétonique, chauffé avec de l'iodure de sodium, soluble dans l'acétone, réagit en donnant l'iodure d'alkyle et le chlorure de sodium qui précipite. De même, l'action du trifluorure d'antimoine SbF3 ou du fluorure mercureux Hg2F2 conduit aux fluorures d'alkyle.
Les dérivés chlorofluorés du méthane et de l'éthane sont fabriqués industriellement par action de l'acide fluorhydrique anhydre sur les dérivés chlorés en présence de pentachlorure d'antimoine. Ces dérivés, dont les noms commerciaux sont Foranes (France), Fréons (États-Unis), Frigènes (R.F.A.), sont des gaz ou des liquides très volatils, ininflammables, qui furent très employés comme fluides réfrigérants de sécurité pour des installations de réfrigération, comme gaz propulseurs pour aérosols, liquides pour extincteurs, ainsi que solvants pour nettoyage à sec. Mais ces chlorofluorocarbures (C.F.C.) contribuent à la destruction de l’ozone stratosphérique, et des réglementations se sont mises en place, à partir de la fin des années 1970, afin d’en interdire la production, le commerce et l’emploi.
Les alcanes perfluorés CnF2n+2 sont obtenus par perfluoration des hydrocarbures par le trifluorure de cobalt (III).
Le tétrafluoréthylène est obtenu par pyrolyse du chlorodifluorométhane ; il est polymérisé, en présence de peroxydes, en un matériau plastique de hautes performances, résistant à la chaleur et aux agents chimiques, le polytétrafluoroéthylène, appelé Téflon⌖ (États-Unis).
Parmi les dérivés halogénés insaturés, le chlorure de vinyle est de loin le plus important ; il est fabriqué par craquage thermique du dichloro-1,2-éthane, lui-même obtenu par oxychloration de l'éthylène (addition du chlore produit par oxydation de l'acide chlorhydrique en présence du catalyseur CuCl2) : C’est un gaz dangereux (cancérigène), utilisé pour produire son polymère, le polychlorure de vinyle.

Les chlorures et bromures d'aryle sont obtenus par action des halogènes sur les arènes : une catalyse par un acide de Lewis est nécessaire dans le cas des aromatiques peu ou pas activés. Les dérivés fluorés sont généralement obtenus par décomposition d'un fluoroborate d'aryldiazonium, lui-même préparé par diazotation d'une arylamine primaire (réaction de Schiemann).
Propriétés physiques
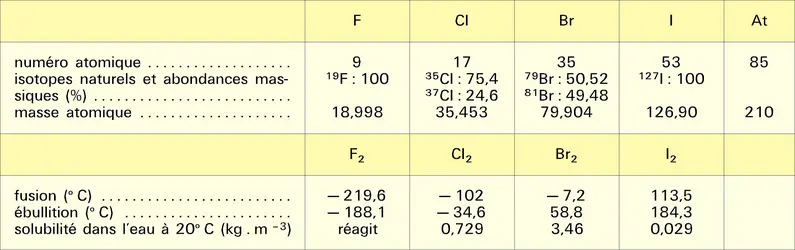
Les halogénures d'alkyle, d'alcényle et d'aryle sont des composés peu associés dont la température d'ébullition augmente avec la condensation en carbone et avec la masse atomique de l'halogène ; en revanche, celle-ci diminue lorsqu'on passe d'un composé à chaîne linéaire à un isomère ramifié au niveau du carbone fonctionnel. Les premiers termes monosubstitués sont des gaz ou des liquides très volatils. La faible association intermoléculaire des halogénures d'alkyle résulte des interactions dipôle-dipôle en phase liquide. Les forces d'attraction de Van der Waals sont d'autant plus intenses que les molécules dipolaires sont plus polarisables et la polarisabilité des liaisons carbone-halogène augmente dans l'ordre : C—F < C—Cl < C—Br < C—I.
Les densités croissent de 0,75 à 0,85 pour les fluorures d'alkyle et décroissent de 0,92 à 0,85 pour les chlorures, de 1,73 à 1,17 pour les bromures lorsque la condensation en carbone augmente. Tous les iodures sont plus denses que l'eau. Les dérivés polyhalogénés ont des densités importantes : 4,2 pour le tétraiodométhane CI4.
Insolubles dans l'eau, les dérivés halogénés sont solubles dans les solvants organiques. Certains sont utilisés comme solvants : le dichlorométhane, le tétrachlorure de carbone (solvant d'extraction plus dense que l'eau), le tri- et le tétrachloroéthylène (solvants industriels pour le dégraissage des pièces métalliques, pour le nettoyage à sec). Les dérivés halogénés sont transparents dans le visible, mais présentent des réfractivités importantes, notamment pour les dérivés iodés.
Le spectre infrarouge des halogénures d'alkyle est caractérisé par des bandes situées dans les régions 1 400-1 000 cm–1 pour les fluorures, 800-600 cm–1 pour les chlorures, 600-500 cm–1 pour les bromures et 500 cm–1 pour les iodures.
La résonance magnétique nucléaire du carbone 13C lié à un halogène est caractéristique.
Les spectres de masse des chlorures et des bromures présentent des figures caractéristiques dues à la composition isotopique particulière des deux halogènes (35Cl/37Cl = 100/32 ; 79Br/81Br = 100/98).
Propriétés chimiques
Les halogénures d'alkyle, d'alcényle et d'aryle présentent une réactivité diversifiée, liée à leurs structures électronique et stérique. Ils interviennent comme substrats dans deux modes de réactions complémentaires et souvent concomitants : la substitution nucléophile et l'élimination. Dans tous les cas, les iodures réagissent plus vite que les bromures, eux-mêmes plus réactifs que les chlorures, les fluorures étant habituellement assez inertes sauf en série aromatique. Les dérivés halogénés susceptibles de former un carbocation stable (dérivés tertiaires, allyliques, benzyliques) réagissent habituellement par un processus unimoléculaire SN1/E1. Le mécanisme bimoléculaire SN2/E2 se rencontre dans le cas d'halogénures formant difficilement un carbocation (primaires et peu encombrés) ; les halogénures secondaires possèdent une réactivité intermédiaire faisant intervenir simultanément les deux mécanismes.
Réactions de substitution nucléophile
Les nombreuses réactions de substitution nucléophile présentées par les halogénures d'alkyle peuvent être utilement classées en fonction de la nature de l'élément introduit dans la structure. Elles sont pratiquement toutes utilisées comme réactions de synthèse pour introduire un groupement fonctionnel ou modifier une chaîne carbonée. La stéréochimie de la substitution SN2 est essentiellement une inversion de configuration, celle de la SN1 est préférentiellement une rétention ou une racémisation.
Réactions avec formation d'une liaison carbone-halogène
Les ions bromure et iodure sont des nucléophiles susceptibles d'attaquer les halogénures d'alkyle, avec échange d'halogènes, dans une réaction équilibrée ; les proportions, à l'équilibre, dépendent de la nucléophilie relative des réactifs mis en œuvre. La réaction peut être rendue totale en éliminant l'un des produits formés ; c'est ainsi que l'on transforme des chlorures et bromures d'alkyle en iodures par action, dans de l'acétone anhydre, de l'iodure de sodium (soluble dans ce solvant) : le chlorure et le bromure de sodium formés, étant insolubles, précipitent, et l'échange est pratiquement total.
Réactions avec formation d'une liaison carbone-oxygène
De nombreux nucléophiles oxygénés réagissent avec les halogénures d'alkyle. L'eau conduit aux alcools dans un processus équilibré, lent pour les dérivés primaires (SN2), rapide pour les tertiaires (SN1). L'emploi d'une base forte comme la soude (réactif HO– beaucoup plus nucléophile que H2O) accélère la réaction SN2 et la rend irréversible mais provoque, pour les halogénures tertiaires, une réaction parallèle d'élimination.
L'alcoolyse conduit aux éthers, elle est voisine de l'hydrolyse : lente pour les halogénures primaires, elle est rapide pour les tertiaires. L'emploi d'un alcoolate accélère la réaction (réaction de Williamson) mais entraîne la réaction parallèle d'élimination (cf. éthers-oxydes) :

L'acidolyse conduit aux esters, elle est soumise aux mêmes conditions que l'alcoolyse. L'emploi d'un sel d'acide carboxylique accélère la réaction (nucléophile moyen) sans provoquer d'élimination (base moyenne) [cf. esters].
Les nitrites alcalins réagissent en donnant un nitrite d'alkyle accompagné de dérivé nitré ; le sel d'argent réagit essentiellement par son site nucléophile azoté et donne majoritairement le dérivé nitré.
Réactions avec formation d'une liaison carbone-soufre
Les nucléophiles sulfurés sont plus réactifs que leurs analogues oxygénés et la substitution (SN2) des halogénures par les anions hydrogénosulfure (HS–) ou mercaptide (RS–) est beaucoup plus rapide que celle des anions hydroxyde ou alcoolate. Ces réactions conduisent aux mercaptans (thiolalcools) et aux sulfures d'alkyle :

Réactions avec formation d'une liaison carbone-azote
L'ammoniac et les amines primaires et secondaires réagissent en formant des halogénures d'ammonium substitués qui, par action d'une base, conduisent aux amines correspondantes, ce qui constitue une de leurs méthodes de préparation. Les amines tertiaires réagissent en formant un halogénure d'ammonium quaternaire.
De nombreuses synthèses de matières actives pour médicaments mettent à profit la différence de réactivité des deux halogènes du bromo-1-chloro-3-propane, pour introduire un chaînon —(CH2)3— dans une structure dissymétrique.
Réactions avec formation d'une liaison carbone-hydrogène
L'hydrogénation (la deutériation) des halogénures d'aryle par substitution nucléophile est réalisée au moyen des réactifs donneurs d'hydrure (de deutérure), notamment les complexes métalliques comme AlLiH4.
Réactions avec formation d'une liaison carbone-carbone
De très nombreuses réactions d' alkylation de substrats carbonés sont réalisées par attaque d'un halogénure d'alkyle par un nucléophile formé à partir d'une chaîne carbonée. Ces réactifs sont essentiellement des organométalliques et des énolates. D'autres nucléophiles carbonés comme les cyanures alcalins réagissent avec les mêmes substrats pour donner des nitriles. Les composés aromatiques, faiblement nucléophiles, sont alkylés par les halogénures d'alkyle, en présence d'un catalyseur comme le chlorure d'aluminium AlCl3 ou le chlorure ferrique FeCl3 (réaction de Friedel et Crafts).
La réaction de duplication des chaînes carbonées par action du sodium sur un iodure d'alkyle (réaction de Wurtz) fait intervenir intermédiairement un organosodé qui est le nucléophile qui attaque une seconde molécule de substrat.
Réactions avec les métaux
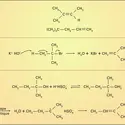
Les halogénures d'alkyle réagissent avec les métaux électropositifs, en présence d'un solvant complexant (éther-oxyde), pour former un dérivé organométallique. La réaction procède par deux échanges monoélectroniques successifs entre le métal et l'halogénure. Cette réaction est très générale et concerne pratiquement tous les dérivés : chlorures, bromures, iodures d'alkyle primaires, secondaires, tertiaires, de vinyle et d'aryle ; seules les conditions varient. L'encombrement stérique au niveau du carbone fonctionnel n'est pas un facteur limitant ; la réaction du magnésium avec les halogénures de vinyle et d'aryle se réalise plus rapidement et plus complètement au sein du tétrahydrofuranne (plus basique que l'éther éthylique) ; les chlorures sont moins réactifs que les bromures et que les iodures et seuls quelques fluorures réagissent avec le métal. Outre le magnésium qui est de loin le plus important (Grignard, 1905), d'autres métaux réagissent avec les halogénures pour former un organométallique : le lithium, au sein du pentane ou de l'éther, réagit en formant un organolithien particulièrement réactif. L'une des réactions les plus intéressantes de ces dérivés organiques du lithium est leur transformation en dérivés du cuivre, sous l'action de l'iodure de cuivre : le dialkylcuprate de lithium formé est un réactif spécifique du couplage avec les halogénures pour construire de nouvelles chaînes carbonées (Gilman). La réaction suivante décrit un exemple d'application industrielle de cette suite de réactions pour la synthèse d'une phéromone : le tricosène-9 Z. Ce produit est utilisé comme leurre pour attirer les mouches vers des appâts traités aux insecticides :

Réactions d'élimination
Les halogénures d'alkyle subissent, sous l'action des bases, des réactions d'élimination des éléments d'une molécule d'acide halogéné, avec formation d'un alcène. Ces réactions mettent en jeu l'un des atomes d'hydrogène portés par un site adjacent au carbone fonctionnel (β-élimination). Lorsque la molécule d'halogénure présente plusieurs atomes d'hydrogène susceptibles d'être éliminés par la base, la réaction conduit généralement à des mélanges d'alcènes. D'autre part, ainsi qu'il a été indiqué, substitution nucléophile et élimination par une base sont des réactions parallèles, très souvent concomitantes. Comme la substitution nucléophile, l'élimination peut se produire par deux mécanismes principaux, en une étape (E2) ou en deux étapes (E1). L'élimination en une étape (mécanisme bimoléculaire E2) se produit sur les halogénures d'alkyle primaires ou secondaires, comme la substitution SN2. Elle est favorisée par l'encombrement du substrat au niveau du carbone fonctionnel, par l'emploi d'une base forte ainsi que par une élévation de la température. À la différence de la substitution SN2, l'élimination E2 impose au substrat une conformation particulière dans laquelle les liaisons Cα—halogène et Cβ—H sont coplanaires et antiparallèles (trans élimination). L'orientation (régiosélectivité) de l'élimination E2 est essentiellement liée à des facteurs stériques : l'alcène qui se forme préférentiellement est l'éthylène le plus substitué (Saytseff).
L'élimination E1 procède en deux étapes : la première, qui est la dissociation de l'halogénure avec formation d'un carbocation, est identique à la première étape du processus SN1, elle est suivie par l'arrachement d'un proton en α du centre cationique. À la différence du mécanisme E2, le processus E1 n'impose pas de conformation particulière au substrat mais, comme dans la réaction SN1, le carbocation intermédiaire peut subir des réarrangements. La régiosélectivité du processus E1 favorise aussi l'oléfine la plus substituée.
En dehors des éliminations β qui transforment les halogénures d'alkyle en oléfines, il existe une élimination α qui, sous l'action d'une base forte, extrait d'un dérivé halogéné les éléments d'un acide halogéné, portés par le même atome de carbone. Un exemple important est celui du substrat trichlorométhane ( chloroforme) qui, à température ordinaire, réagit avec la soude dans un processus en deux étapes conduisant à la formation de dichlorocarbène Cl2C : intermédiaire très réactif.
Halogénures insaturés
Halogénures allyliques et benzyliques
Les dérivés, dont l'halogène est porté par un atome de carbone saturé (sp3) lié à une structure insaturée, éthylénique, acétylénique ou aromatique, présentent des propriétés particulières. Ils sont caractérisés par une très grande mobilité de l'halogène aussi bien en substitution qu'en élimination. L'ion carbénium formé dans la première étape des processus SN1 et E1 sur un halogénure allylique est stabilisé par la délocalisation de la charge (conjugaison) : l'énergie d'activation est plus faible que celle qui correspond à un substrat saturé et la réaction est fortement accélérée. La même tendance, quoique plus modeste, est observée dans le cas de réactions SN2. L'état conjugué du cation allylique intermédiaire est responsable d'une double orientation de la réaction de substitution SN1 : le bromure de crotyle subit l'éthanolyse en donnant 15 p. 100 d'éther normal et 85 p. 100 d'éther réarrangé (réarrangement allylique).
Halogénures vinyliques et aromatiques
À la différence de leurs homologues β-insaturés, les dérivés vinyliques et aromatiques qui portent leur atome d'halogène sur un carbone sp2 sont très peu réactifs : la liaison C—halogène est stabilisée par conjugaison entre un doublet non partagé de l'halogène et le système π du substrat. Bien que ces dérivés forment normalement des organomagnésiens par attaque du magnésium au sein du tétrahydrofuranne, leur hydrolyse est très difficile, même en présence d'un sel d'argent. La transformation du chlorobenzène en phénol nécessite des conditions très sévères : soude à 15 p. 100, 390 0C, 3 × 107 Pa.
Le chlorure de vinyle est polymérisé par voie radicalaire (initiation par des peroxydes) ; le polychlorure de vinyle est l'un des plus importants polymères techniques. Il est utilisé pour la fabrication d'objets moulés, de fibres textiles, de cuir artificiel. Copolymérisé avec d'autres monomères (acétate de vinyle, esters et nitrile acryliques), il offre une gamme variée de matériauxplastiques aux usages très diversifiés.
Applications
Les dérivés halogénés sont certainement les composés organiques les plus importants comme intermédiaires de synthèse ; ils ont également de très nombreuses applications dans les domaines les plus divers : il sont employés comme solvants (trichloro- et perchloroéthylène pour le nettoyage à sec, chlorure de méthylène pour l'extraction des corps gras), comme fluides extincteurs (tétrachlorure de carbone), comme anesthésique (bromo-2-chloro-2-trifluoroéthane ou halothane ; toxique pour le cœur et le foie, il n’est plus guère utilisé), comme base de sang artificiel (perfluoroalcanes CnF2n+2). Les applications les plus importantes concernent les insecticides (dichlorodiphényltrichloréthane ou D.D.T., isomère γ de l'hexachloro-1,2,3,4,5,6-cyclohexane ou lindane) et surtout les matières plastiques (polychlorure de vinyle ou P.V.C. (—CH2—CHCl—)n) et les dérivés bromés, additifs d'ignifugation des polyuréthanes.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
- Robert de PAPE : maître de conférences à la faculté des sciences du Mans
Classification
Médias
Autres références
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 642 mots
- 4 médias
-
ALCYNES
- Écrit par Jacques METZGER
- 3 302 mots
- 5 médias
-
ASTATE
- Écrit par Encyclopædia Universalis et Bernard PIRE
- 564 mots
Élément chimique de symbole At et de numéro atomique 85, l'astate (du grec astatos, instable) a autrefois été appelé ékaiode (car ses propriétés chimiques se rapprochent de celles de l'iode, l'halogène qui le précède dans le tableau périodique) et alabame. Les Anglo-Saxons le nomment...
-
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 554 mots
- 5 médias
- Afficher les 14 références
Voir aussi
- CYANOGÈNE
- CHLORURE DE VINYLE
- ÉLECTRONÉGATIVITÉ
- DENSITÉ
- ANHYDRIDES
- HALOGÉNÉS DÉRIVÉS
- HYDRACIDES
- MARKOVNIKOV RÈGLE DE
- ALKYLATION ou ALCOYLATION
- FRIEDEL & CRAFTS RÉACTIONS DE
- DEGRÉ D'OXYDATION
- WURTZ MÉTHODE DE
- OXYDANTS
- DISMUTATION, chimie
- ÉLIMINATION, chimie
- HALOGÉNURES INSATURÉS
- ÉLÉMENTS CHIMIQUES
- CLUSTER
- CYANURES
- CYANATES
- NUCLÉOPHILES SUBSTITUTIONS
- PSEUDO-HALOGÈNES
- TÉFLON ou POLYTÉTRAFLUOROÉTHYLÈNE (PTFE)
- WILLIAMSON RÉACTION DE
- CYANURE DE SODIUM
- CHLOROFORME
- FLUORHYDRIQUE ACIDE
- IODURE D'HYDROGÈNE
- CYANURATION
- CYANHYDRIQUE ACIDE
- FLUIDES FRIGORIGÈNES
- OXYDES
- HALOGÉNURES
- RÉACTIVITÉ CHIMIQUE
- POLYCHLORURE DE VINYLE (PVC) ou CHLORURE DE POLYVINYLE
- TEMPÉRATURE D'ÉBULLITION
- HALOGÉNURES D'ALCÉNYLE
- HALOGÉNURES D'ALKYLE
- HALOGÉNURES D'ARYLE
- CHLOROFLUOROCARBURES (CFC)