HÉMOGLOBINE
Article modifié le
L 'hémoglobine est la molécule d'importance vitale qui, chez les Vertébrés, achemine l' oxygène depuis les poumons, ou les branchies, jusqu'aux tissus, et en retour favorise le transport, par le sang, du gaz carbonique des tissus aux poumons, ou aux branchies.
Étant une protéine, l'hémoglobine se compose d'aminoacides liés entre eux de façon séquentielle en une chaîne linéaire dite polypeptidique. Les diverses sortes d'aminoacides qui réalisent cette chaîne se succèdent en fonction d'un déterminisme génétique qui assigne à chacun sa place dans la séquence polypeptidique.
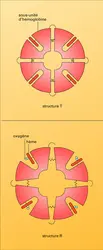
La molécule d'hémoglobine est formée par quatre chaînes polypeptidiques deux à deux semblables : deux chaînes α qui contiennent 141 maillons aminoacides et deux chaînes β qui en renferment 146. Bien que leurs séquences en aminoacides soient différentes, ces chaînes α et β sont repliées en structures tridimensionnelles à conformation similaire. Chaque chaîne abrite un hème, petite molécule cyclique porphyrinique (donnant sa couleur rouge au sang). Elle est constituée par un anneau d'atomes de carbone, d'azote et d'hydrogène, au centre duquel s'attache un atome de fer. Un polypeptide, avec l'hème qu'il porte, forme une sous-unité qu'on appelle monomère de la molécule d'hémoglobine. Celle-ci rassemble donc quatre sous-unités en un tétramère.
Rôle de l'hémoglobine
Le muscle rouge contient une protéine, la myoglobine, qui ressemble par sa constitution et sa structure à la sous-unité β de l'hémoglobine, car elle est formée d'une seule chaîne polypeptidique à laquelle s'attache un hème.
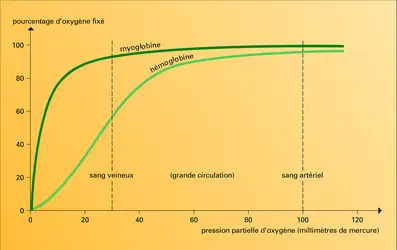
La myoglobine se combine à l'oxygène que lui cèdent les globules rouges du sang ; après s'en être chargée, elle l'apporte aux mitochondries, organites subcellulaires dans lesquels de l'énergie est libérée, à la faveur des processus de combustion du glucose, avec formation de dioxyde de carbone et d'eau (cf. bioénergétique).
Avec ses 2 500 atomes de carbone, azote, oxygène, hydrogène et soufre, la myoglobine, plus simple que l'hémoglobine, possède une structure tridimensionnelle qui fut la première à être élucidée, par J. C. Kendrew et ses collaborateurs. Elle a pour seule fonction de permettre la liaison chimique labile entre son unique atome de fer et une molécule d'oxygène : O2. Lorsqu'elle est dépourvue d'oxygène, une solution de myoglobine ou d'hémoglobine est pourpre, comme le sang veineux, mais, lorsque l'oxygène lui est insufflé, elle devient écarlate, comme le sang artériel. Si, dans leur fonction de transporteur d'oxygène, ces deux protéines doivent coopérer, l'une, l'hémoglobine, prélèvera de l'oxygène dans les poumons, où il est abondant, pour le donner à l'autre, la myoglobine, dans les capillaires du muscle où ce gaz est en faible quantité ; la myoglobine, à son tour passera l'oxygène aux mitochondries, où il est plus raréfié encore.
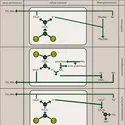
Une expérience simple montre que myoglobine et hémoglobine peuvent accomplir cet échange parce qu'il y a un équilibre entre l'oxygène libre et l'oxygène lié au fer de l'hème. Imaginons un récipient construit de manière à pouvoir mélanger un grand volume de gaz à une solution de myoglobine, et permettant d'étudier les variations de sa couleur à l'aide d'un spectroscope. En l'absence d'oxygène, on observe seulement la coloration pourpre de la désoxymyoglobine. Si on introduit un peu d'oxygène, une certaine quantité de celui-ci se combine à une quantité aliquote de désoxymyoglobine pour produire de l'oxymyoglobine de couleur écarlate. On évalue à l'aide du spectroscope la quantité d'oxymyoglobine dans la solution. On répète l'expérience (introduction d'oxygène, puis mesure spectroscopique) jusqu'à ce que la totalité de la myoglobine ait[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Max Ferdinand PERUTZ : Dr., membre du M.R.C. Laboratory of Molecular Biology
Classification
Médias
Autres références
-
ACIDO-BASIQUE ÉQUILIBRE
- Écrit par Pierre KAMOUN
- 2 958 mots
- 1 média
Le système érythrocytaire est constitué par l'ensemblehémoglobine- oxyhémoglobine qui, pour le pH sanguin normal, jouent le rôle d'acides faibles. Cependant, la constante de dissociation de l'oxyhémoglobine est supérieure à celle de l'hémoglobine, ce qui revient à dire que... -
ANÉMIES
- Écrit par Bruno VARET
- 3 094 mots
- 5 médias
Lesvaleurs suivantes sont généralement considérées pour définir une anémie : hémoglobine inférieure à 13 grammes chez l'homme après la puberté ; à 12 grammes chez la femme et chez l'enfant avant la puberté ; à 10,5 grammes chez la femme enceinte de plus de trois mois ; à 14 grammes chez le nouveau-né.... -
BRAGG sir WILLIAM HENRY (1862-1942) & sir WILLIAM LAWRENCE (1890-1971)
- Écrit par Christian BRACCO
- 1 790 mots
- 1 média
...la physique nucléaire développée par son prédécesseur. William Lawrence Bragg encourage dès 1938 le travail de Max Ferdinand Perutz (1914-2002) sur la structure de l’hémoglobine, d’une complexité sans commune mesure avec ce qui avait été tenté jusqu’alors. M. Perutz et John Cowdery Kendrew... -
FER - Rôle biologique du fer
- Écrit par Carole BEAUMONT
- 4 732 mots
- 3 médias
Les besoins en fer sont très importants au cours de l'érythropoïèse, principalement pour assurer la synthèse d'hème et la formation del'hémoglobine. Les précurseurs érythropoïétiques de la moelle osseuse, qui ne peuvent acquérir leur fer que par le biais de la transferrine, expriment à leur... - Afficher les 26 références
Voir aussi
- FŒTALE VIE
- HYDROGÈNE LIAISON
- GLOBINE
- ALLOSTÉRIE
- STRUCTURE, biologie
- MYOGLOBINE
- POLYPEPTIDIQUE CHAÎNE
- HISTIDINE
- HÈME
- HÉMOPROTÉINES
- OXYHÉMOGLOBINE
- BICARBONATE
- BOHR EFFET, physiologie
- HÉMATIE ou GLOBULE ROUGE ou ÉRYTHROCYTE
- HILL COEFFICIENT DE
- RESPIRATION
- GAZ DU SANG
- MONOXYDE DE CARBONE ou OXYDE DE CARBONE (CO)
- MOLÉCULES BIOLOGIQUES, structure et fonction
- ÉCHANGES GAZEUX, physiologie
- PRESSION PARTIELLE
- PROTÉINES
- CARBONIQUE GAZ ou DIOXYDE DE CARBONE