HÉMOGLOBINOPATHIES
Article modifié le
L' hémoglobine peut être l'objet des modifications héréditaires. Chez le sujet homozygote, ces mutations entraînent la synthèse d'une hémoglobine anormale et il en résulte des troubles cliniques plus ou moins graves. En revanche, chez le sujet hétérozygote, de l'hémoglobine normale est formée, de telle sorte que le défaut est pour ainsi dire camouflé et l'affection est le plus souvent latente. La maladie observée s'appelle une hémoglobinopathie, pour rendre compte de son origine moléculaire, et l'ensemble des anomalies qui en résultent dans le sang constitue la catégorie morbide des hémoglobinoses.
Ces maladies revêtent une grande importance : d'une part, le nombre des sujets qui en sont atteints est élevé (un individu sur six cents), d'autre part, leur étude permet d'expliquer, à l'échelle moléculaire, la physiologie de l'hémoglobine, et à l'échelle de son gène, les mécanismes de sa production, voire de sa régulation.
Hémoglobines normales et hémoglobines anormales
Toutes les hémoglobines (normales ou anormales) possèdent le même noyau prosthétique. Les différences observées ne portent que sur la partie protéique, la globine.
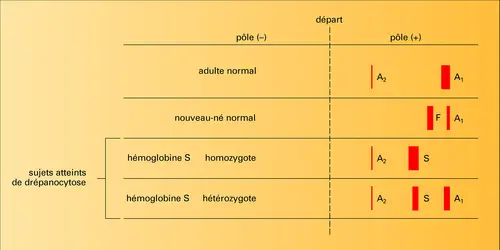
La séparation des hémoglobines est habituellement fondée sur les propriétés de la charge électrique de la globine. Celle-ci, comme toutes les protéines, est un ampholyte ; les fonctions acides et bases libres portées par les acides aminés de la protéine sont plus ou moins ionisées selon le pH du milieu. La protéine présente donc une charge globale positive ou négative selon le pH. Placées dans un champ électrique, à un pH donné, les hémoglobines migrent vers l'un des pôles.
Hémoglobines normales
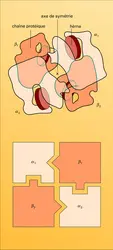
L'homme possède dans son sang plusieurs variétés d'hémoglobines, molécules toujours formées par quatre chaînes protéiques, identiques deux à deux, et qui établissent entre elles des liaisons très importantes pour le fonctionnement de l'ensemble (fig. 1). Une de ces chaînes, appelée chaîne α, est présente dans toutes les variétés d'hémoglobine ; elle est couplée avec l'une des trois autres chaînes : β, γ, δ. De ce fait, les hémoglobines normales correspondent à trois types : A1, A2, F. La figure 3 montre comment on peut les reconnaître par électrophorèse.
Toute protéine est constituée par un enchaînement d'acides aminés (appelé séquence) formant la structure primaire de cette chaîne. L'observation des ressemblances et des variations de la séquence des quatre chaînes α, β, γ et δ, la comparaison avec la séquence d'une autre protéine héminique, la myoglobine, qui donne aux muscles leur couleur rouge, et la permanence de la chaîne α dans toutes les hémoglobines ont permis à V. M. Ingram d'avancer l'hypothèse d'un schéma évolutif au niveau moléculaire : une protéine ancestrale, ressemblant à la myoglobine, aurait donné naissance à la chaîne α ; celle-ci, par de nouvelles modifications, aurait produit la chaîne γ et enfin les chaînes β et δ.
Hémoglobines anormales
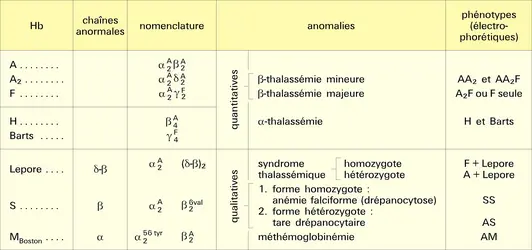
Six cents hémoglobines anormales ayant été individualisées, leur nomenclature pose un problème difficile. Les chaînes de globine sont symbolisées par des lettres grecques affectées d'un exposant qui correspond, soit à l'hémoglobine normale, soit à l'hémoglobine anormale. Lorsque la nature de l'anomalie a été précisée, l'exposant indique le rang et le nom de l' acide aminé substitué dans la chaîne atteinte (cf. tableau).
Les maladies de l'hémoglobine sont dues à deux types d'anomalies :
– Dans le premier cas, celui des thalassémies, la synthèse d'une chaîne tout entière est déficiente, alors que la structure des chaînes produites demeure normale, mais avec anomalie d'assemblage. On peut citer les hémoglobines H, Barts, etc.[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel COHEN-SOLAL : maître de recherche à l'I.N.S.E.R.M., C.H.U. Henri-Mondor, Créteil
- Jean-Claude DREYFUS : professeur honoraire à la faculté de médecine Cochin-Port-Royal
Classification
Médias
Autres références
-
PATHOLOGIE MOLÉCULAIRE DES HÉMOGLOBINES - (repères chronologiques)
- Écrit par Dominique LABIE
- 189 mots
1949 L. Pauling : isolement par électrophorèse de l'hémoglobine S de la drépanocytose.
1956 V. Ingram : notion de maladie moléculaire (différence de structure entre hémoglobines A et S).
1959 V. Ingram : phylogénie des hémoglobines et démembrement des thalassémies.
1960...
-
ANÉMIES
- Écrit par Bruno VARET
- 3 094 mots
- 5 médias
...– les anémies corpusculaires et constitutionnelles dues à une anomalie de la membrane ( sphérocytose héréditaire, elliptocytose héréditaire...), à une anomalie de l'hémoglobine sans défaut de synthèse (hémoglobine S homozygote, hémoglobine SC, hémoglobine instable) ; à une anomalie enzymatique (déficit... -
CYANOSE
- Écrit par François BOURNÉRIAS
- 145 mots
Coloration bleutée de la peau et des muqueuses, prédominant aux extrémités. Elle résulte d'une augmentation du taux de l'hémoglobine réduite dans le sang périphérique et apparaît lorsque ce taux dépasse 5 grammes pour 100 millilitres.
Il faut distinguer : la cyanose centrale...
-
FIÈVRE BILIEUSE HÉMOGLOBINURIQUE
- Écrit par François BOURNÉRIAS
- 223 mots
-
HÉMATOLOGIE
- Écrit par Jean BERNARD et Michel LEPORRIER
- 8 479 mots
- 1 média
...héréditaires, raciales ou familiales, qui atteignent des millions d'hommes en Afrique, en Asie, en Amérique, en Europe méditerranéenne sont dues à la présence d'hémoglobines anormales. Dans la structure de chaque hémoglobine se trouve une chaîne rigoureusement ordonnée d'une centaine d' acides aminés. Le changement... - Afficher les 14 références
Voir aussi
- MATURATION DE L'ARN
- HÉRÉDITAIRES MALADIES ou MALADIES GÉNÉTIQUES
- GLOBINE
- HÉMOGLOBINOSES
- TRANSCRIPTION, biologie moléculaire
- TRADUCTION, biologie moléculaire
- DRÉPANOCYTOSE ou ANÉMIE FALCIFORME
- MÉTHÉMOGLOBINE
- POLYPEPTIDIQUE CHAÎNE
- HÈME
- LEPORE HÉMOGLOBINE
- THALASSÉMIE
- HÉMATIE ou GLOBULE ROUGE ou ÉRYTHROCYTE
- CROSSING-OVER, génétique
- PROTÉINES BIOSYNTHÈSE DES
- HOMOZYGOTE
- HÉTÉROZYGOTE
- RÉCESSIVITÉ, génétique
- GÉNÉTIQUE MOLÉCULAIRE
- HÉMOPATHIES
- PROTÉINES
- ÉPISSAGE, génétique moléculaire