TAUBE HENRY (1915-2005)
Chimiste américain, né le 30 novembre à Neudorf dans le Saskatchewan (Canada), Henry Taube initia une véritable renaissance de la chimie minérale. Henry Taube fut un personnage, de son vivant déjà hissé sur un piédestal, non seulement par ses collaborateurs et ses collègues du département de chimie de Stanford, mais par l'ensemble des chimistes. Le prix Nobel de chimie, qui lui fut décerné tardivement en 1983, exprimait une évidence. Notons au passage qu'il fait partie du petit nombre des lauréats « monocéphales » en chimie depuis 1950.
Henry Taube opta pour la science plutôt que pour l'agriculture lorsqu'un enseignant de terminale, Paul Liefield, le fit s'inscrire à Luther College de Regina, où le jeune homme fut assistant de laboratoire, en échange de ses frais de séjour et de scolarité. Taube suivit ensuite les enseignements de l'université du Saskatchewan avant de préparer son doctorat à l'université de Californie à Berkeley. Il y soutint sa thèse en 1940 et y resta une année supplémentaire comme instructor (maître-assistant). Ce séjour à Berkeley fut décisif. Taube s'initia en particulier aux techniques de marquage isotopique, tirant parti de nombreux isotopes artificiels radioactifs, disponibles sur place. En 1941, Taube fut appelé à faire partie du corps enseignant de Cornell (Ithaca, New York). Il y resta jusqu'en 1946, date de son élection à l'université de Chicago, où il séjourna jusqu'en 1961. Ce fut ensuite Stanford, jusqu'à sa retraite en 1986. Déjà à la tête du département de chimie à Chicago (1956-1959), Taube dirigea aussi à deux reprises, et très longuement celui de Stanford (1952-1974 et 1978-1979), ce qui atteste de la confiance réitérée de ses collègues.
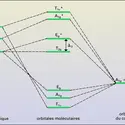
Ce n'est qu'après sa venue à Chicago qu'il s'intéressa aux transferts électroniques entre des complexes de métaux. Il y fut amené par l'enseignement, ce qu'il ne manquait pas de souligner. L'observation que, pour des complexes hexacoordinés d'ions métalliques de même charge et de rayon similaire, la vitesse de substitution varie énormément l'intrigua. Il mit ce fait en rapport avec les diagrammes orbitalaires fournis par la théorie du champ de ligandes. En effet, lorsque les électrons, dans un processus d'oxydoréduction, migrent via un groupe d'atomes pontant deux complexes de coordination, en un processus qu'on qualifie de sphère interne, Taube montra qu'il fallait distinguer un transfert de résonance par effet tunnel et un mécanisme de saut, par lequel, soit le réducteur peuple une orbitale vacante d'une ligande, soit l'oxydant troue une orbitale occupée. Telle est la contribution majeure de Taube, qui figure à présent dans tout manuel de chimie inorganique.
Les découvertes de Taube – le jury du prix Nobel n'en dénombra pas moins de 18, citées explicitement – eurent des retombées pratiques ; en particulier par la mise au point de nombreux catalyseurs utilisés en chimie industrielle. Plus généralement, les recherches de Taube portèrent sur les fondements des transferts d'électrons, les mécanismes des réactions de la chimie minérale tant de substitution que d'oxydoréduction, la relation entre la réactivité et la configuration électronique des espèces chimiques, la rétrodonation d'électrons et son influence sur la stabilité et la réactivité d'une entité, les molécules à valence mixte, les chimies du dioxygène et du diazote, celle des halogènes, des métaux de transition et des métaux de la famille du platine... tous les fondements de la chimie minérale moderne.
Homme de laboratoire, épris d'enseignement, Taube aimait à se distraire de temps à autre de ses tâches administratives. Une canette de bière à la main, il faisait le tour de son groupe de recherches, allant aux nouvelles, pariant[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre LASZLO : professeur honoraire à l'École polytechnique et à l'université de Liège (Belgique)
Classification
Autres références
-
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL et Jean-Pierre SCHARFF
- 4 895 mots
- 4 médias
Il existe deux types de transfert d'électrons. Letransfert électronique d'un complexe à un autre fait intervenir la formation transitoire d'un complexe activé ponté mis en évidence à l'aide d'isotopes radioactifs par Taube et ses collaborateurs. [Co(NH3)536Cl*]2+ par exemple...