HÉTÉROCYCLES
Article modifié le
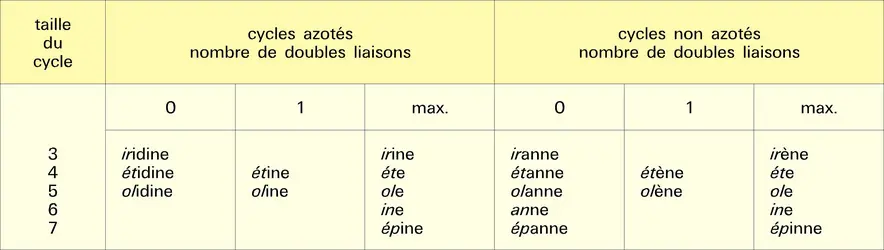
Hétérocycles à trois et quatre chaînons
Hétérocycles monohétéroatomiques à trois chaînons
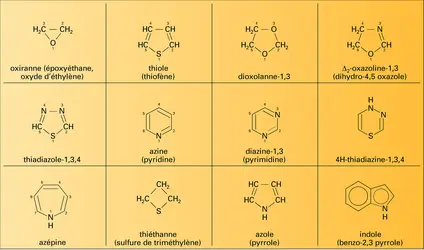
Les composés saturés de base sont l' aziridine ou éthylène-imine, l' oxiranne et le thiiranne.
Préparation
Une méthode générale (réaction) consiste à traiter par une base un dérivé difonctionnel-1,2 dans lequel l'une des fonctions, nucléophile, apporte l'hétéroatome Z (amine Z = NH, alcool Z = O, thiol Z = S) et l'autre, Y, est un groupe facilement remplaçable par un mécanisme SN2 (ou éventuellement SN1) comme un halogène, une fonction ester sulfonique, un groupe ammonium quaternaire. Le rôle de la base est d'activer la réactivité nucléophile de la fonction ZH en la transformant en sa base conjuguée Z-. Cette méthode est encore utilisée à l'échelle industrielle pour préparer l'époxypropane ou oxyde de propylène à partir de la chlorhydrine du propylène glycol (chloro-1-hydroxy-2-propane) dérivant elle-même du propylène (réaction).
Une méthode également générale de préparation des oxirannes ou époxydes consiste à traiter une oléfine par un réactif apportant un atome d'oxygène électrophile, et qui peut être soit un peracide, soit un hydroperoxyde en présence de catalyseur (réaction).
L'oxyde d'éthylène, ou oxiranne, est préparé industriellement par oxydation directe de l'éthylène par l'air ou l'oxygène à 280 0C sur catalyseur hétérogène à base d'argent.
Propriétés chimiques
Bien que ces composés hétérocycliques à trois chaînons soient des analogues cycliques respectivement des amines, des éthers et des thio-éthers, leur réactivité chimique est considérablement supérieure à celle de ces fonctions aliphatiques. Cette réactivité particulière est attribuée à la structure (électronique et géométrique) de ces cycles à trois chaînons, comparable, dans une certaine mesure, à celle du cyclopropane.
Les réactifs nucléophiles attaquent ces cycles en les ouvrant selon un mécanisme inverse de celui de leur formation (réaction) : l'ouverture du cycle se produit alors au niveau de l'atome de carbone le moins substitué (SN2 sensible à l'effet stérique) ; en catalyse acide par contre, l'ouverture se produit le plus souvent au niveau de l'atome de carbone le plus substitué (importance relative du mécanisme SN1).
Les organométalliques conduisent à l'amine, l'alcool ou le thiol de la classe la plus élevée. Certains réactifs électrophiles (acides, sels de magnésium) catalysent l'isomérisation des époxydes en dérivés carbonylés : préparation de l'éthanal à partir de l'oxyde d'éthylène en présence de bromure de magnésium.
Des réactions de polyaddition, très importantes au plan industriel, sont provoquées par des quantités catalytiques d'agents nucléophiles ou électrophiles : l'oxyde d'éthylène conduit ainsi aux di-, tri-..., polyéthylèneglycols.
Usages
Seuls les époxydes ont trouvé des applications intéressantes. L'oxyde d'éthylène est fabriqué par oxydation directe de l'éthylène, il est l'un des intermédiaires importants de la pétroléochimie moderne. Il sert à fabriquer le glycol (antigel, fibres synthétiques), les polyéthylèneglycols, les éthanolamines (bases), les éthers des mono- et polyglycols (solvants), des détergents non ioniques, et il est lui-même employé comme biocide.
L'oxyde de propylène est fabriqué à partir du propylène soit par le procédé à la chlorhydrine, soit par époxydation directe. Il sert principalement à produire les polypropylèneglycols, matières premières de la fabrication des polyuréthanes (mousses souples ou rigides, matières plastiques).
Hétérocycles monohétéroatomiques à quatre chaînons
Les composés saturés de base sont l' azétidine ou triméthylène-imine, l' oxétanne ou oxyde de triméthylène et le thiétanne ou sulfure de triméthylène.
Parmi les principaux dérivés de ce groupe, il faut citer les azétidinones-2, ou β-lactames, et les oxétannes-2, ou β-lactones. Les pénicillines contiennent un cycle β-lactame et sont d'importants antibiotiques.
Préparation
Les dérivés cycliques non fonctionnels sont préparés par substitution nucléophile intramoléculaire d'un dérivé γ-halogéné, d'une amine (ZH = NH2), d'un alcool (ZH = OH) ou d'un thiol (ZH = SH) [réaction]. Le rôle de la base est encore de rendre plus nucléophile le groupe fonctionnel − ZH en le transformant en sa base conjuguée − Z−. Une méthode commode et générale de préparation des β-lactames et des β-lactones consiste à faire réagir un cétène respectivement sur un dérivé carbonylé ou une imine (réaction).
Propriétés chimiques
Les composés saturés présentent une réactivité intermédiaire entre celle des homologues cycliques à trois chaînons et celle des fonctions aliphatiques correspondantes. Les dérivés α-carbonylés se comportent essentiellement comme des dérivés cycliques de la fonction acide carboxylique. Les β-lactones par exemple subissent la coupure alkyle-oxygène des esters sous l'action d'un nucléophile en catalyse basique tandis que la coupure acyle-oxygène se produit de préférence en catalyse acide (réaction).
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ALCALOÏDES
- Écrit par Jacques E. POISSON
- 5 689 mots
- 5 médias
...catégorie définie de composés chimiques en raison de la variété de leurs structures moléculaires. Toutefois, d'une façon constante, ils possèdent un squelette hétérocyclique azoté, si l'on excepte quelques substances où l'azote est extracyclique (colchicine, éphédrine). La classification la plus accessible est... -
AROMATICITÉ
- Écrit par André JULG
- 4 707 mots
- 2 médias
De même, une molécule aromatique peut contenir des hétéroatomes. Par exemple, dans la pyridine C5H5N (formule 6), qui dérive formellement du benzène par le remplacement d'un groupement CH par un atome d'azote, c'est ce dernier qui fournit un électron au système conjugué. -
AZÉTIDINE ou TRIMÉTHYLÈNE-IMINE
- Écrit par Dina SURDIN
- 64 mots

Masse moléculaire : 57,09 g
Masse spécifique : 0,843 g/cm3
Point d'ébullition : 63 0C.
Liquide incolore, fumant à l'air, d'odeur ammoniacale, soluble en toutes proportions dans l'eau et l'éthanol.
Le cycle à quatre chaînons s'ouvre facilement ; sous l'action de l'acide...
-
AZIRIDINE ou AZACYCLOPROPANE ou DIMÉTHYLÈNIMINE
- Écrit par Dina SURDIN
- 159 mots

Masse moléculaire : 43,07 g
Masse spécifique : 0,832 g/cm3
Point d'ébullition : 56 0C
Huile à très forte odeur ammoniacale, fumant à l'air. Miscible à l'eau, soluble dans l'éthanol.
Également appelée azacyclopropane, diméthylènimine ou bien cyclodiméthylène amine, l'aziridine...
- Afficher les 20 références
Voir aussi
- ÉLECTROPHILES RÉACTIONS
- BASE, chimie
- PYRIMIDINES
- CARBONÉE CHAÎNE
- DIELS-ADLER RÉACTION DE
- CYCLIQUES COMPOSÉS
- FRIEDEL & CRAFTS CATALYSEUR DE
- CYCLISATION
- FRIEDEL & CRAFTS RÉACTIONS DE
- NUCLÉOPHILES SUBSTITUTIONS
- INDOLE NOYAU
- PYRROLE & NOYAU PYRROLIQUE
- HÉTÉROATOME
- ÉPOXYDES
- DIAZINES
- THIOFÈNE ou THIOPHÈNE
- FISCHER BASE DE
- AZOLES
- CONJUGAISON, chimie
- NOMENCLATURE, chimie
- VITAMINE H
- RÉACTIVITÉ CHIMIQUE