HÉTÉROCYCLES
Article modifié le
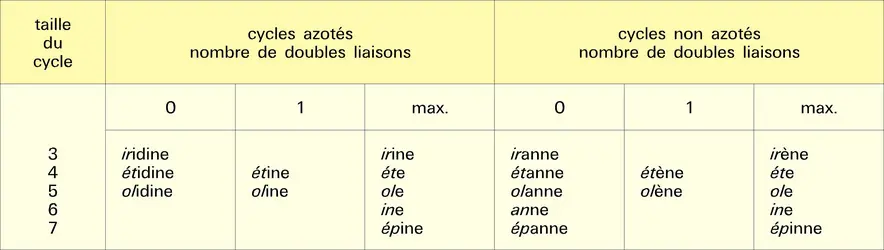
Hétérocycles à cinq chaînons
Hétérocycles monohétéroatomiques à cinq chaînons
Nomenclature et composés importants
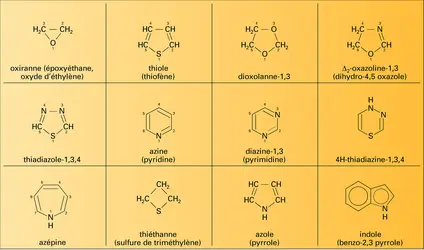
Les trois cycles de base des composés monocycliques aromatiques (formule) sont le pyrrole (Z = NH), le furanne (Z = O) et le thiofène (Z = S). Les radicaux qui en dérivent sont appelés respectivement pyrrolyle, furyle et thiényle. Le radical furyl-2-méthyle est appelé furfuryle.
Le cycle du pyrrole se rencontre dans de nombreux composés naturels ; ainsi les pigments biliaires, qui renferment quatre cycles pyrroliques en chaîne ouverte ; les pigments du sang comme l'hémine, constituant de l'hémoglobine, qui renferme quatre cycles pyrroliques en chaîne fermée dont les atomes d'azote sont les ligands d'un complexe du fer ; les chlorophylles, dont la structure tétrapyrrolique cyclique est stabilisée par complexation d'un atome de magnésium ; la vitamine B12. Le thiofène et ses homologues se rencontrent dans certains pétroles et dans la fraction benzénique des distillats de goudrons de houille.
Les composés monocycliques non aromatiques de base sont les pyrroles di- ou tétrahydrogénés, appelés respectivement pyrrolines et pyrrolidines, les di- et tétrahydrofurannes et di- et tétrahydrothiofènes. Deux amino-acides importants, la proline et l'hydroxyproline, sont des dérivés de la pyrrolidine. Le cycle du tétrahydrofuranne se rencontre dans de nombreux sucres (hexoses) comme par exemple le βD-fructofurannose encore appelé fructose. L'un des dérivés naturels les plus importants du tétrahydrothiofène est la vitamine H ou biotine, présente dans le jaune d'œuf.
Les dérivés de fusion en α, β d'un cycle benzénique sur les hétérocycles pentagonaux aromatiques (formule) portent des noms particuliers : l'indole (Z = NH), le benzofuranne ou coumarone (Z = O) et le thionaphtène (Z = S). Les isomères correspondant à la fusion en β, γ (formule) sont appelés iso-indole, isocoumarone et isothionaphtène. Parmi les dérivés bicycliques importants, on peut citer un amino-acide essentiel, le tryptophane ; une hormone végétale, l'acide indolyl-3-acétique (hétéro-auxine) ; l'indigo, une des premières matières colorantes naturelles employées dans l'industrie, et les nombreux alcaloïdes indoliques comme la yohimbine et la strychnine. Dans certains composés bicycliques, l'hétéroatome d'azote est lui-même engagé dans les deux cycles. C'est le cas en particulier de l'indolizine (formule).
Préparation
Deux méthodes principales sont utilisées pour la synthèse des hétérocycles de cette série :
– les réactions avec formation d'une liaison entre l'hétéroatome et le squelette carboné ; les cycles à caractère aromatique peuvent être obtenus à partir des γ-dicétones. De nombreuses réactions particulières ont été développées pour la synthèse de ces hétérocycles (réactions) ;
– la réaction avec formation de la liaison C3 − C4 ; ici aussi de nombreuses voies ont été proposées, particulièrement en série pyrrolique. On citera seulement : la synthèse des pyrroles selon Knorr, condensation d'un ester β-cétonique avec une α-aminocétone (réaction) ; la synthèse des indoles selon Fischer, qui correspond à un réarrangement orthobenzidinique d'une phénylhydrazone (réaction) ; la synthèse de Hantzsch qui utilise une cétone α-halogénée dans une réaction avec une énamine, un ester β-cétonique ou une aniline pour donner respectivement un pyrrole, un furanne ou un indole (réaction).
Propriétés chimiques
Les réactions typiques de l'hétéroatome des amines, éthers et sulfures aliphatiques ne se retrouvent pas ici, ce qui s'explique aisément par la participation d'un doublet non partagé de l'hétéroatome à la conjugaison cyclique de la molécule avec, comme conséquence, la non-disponibilité de ce doublet pour les réactifs électrophiles. Cette conjugaison est cependant assez limitée dans le cas de l'oxygène si l'on considère la relative facilité avec laquelle les furannes subissent la cyclisation de Diels-Alder, caractéristique des diènes conjugués.
La structure électronique correspond (cf. aromaticité) à une diminution du caractère aromatique dans l'ordre thiofène, pyrrole, furanne, et on rencontre effectivement des réactions d'addition avec le furanne. Les réactifs électrophiles attaquent souvent l'atome de carbone en position 2 des monocyles, et la vitesse de réaction est alors très supérieure à celle du benzène. Les dérivés benzo-, par contre, réagissent de préférence en position 3. Les effets d'activation ou de désactivation sont analogues à ceux qu'on observe en série benzénique (réactions).
La nitration du thiofène donne plus de 80 p. 100 de nitro-2 et moins de 10 p. 100 de nitro-3-thiofène. La sulfonation de cet hétérocycle, plus facile que celle du benzène, fournit l'acide thiényl-2-sulfonique. L'halogénation conduit aux dérivés α-mono- et αα′-dihalogénés du thiofène. Dans les mêmes conditions, le pyrrole subit des résinifications. En présence de catalyseur de Friedel et Crafts le thiofène peut être acylé. D'autres réactifs électrophiles réagissent avec le furanne, le pyrrole et le thiofène, notamment les acides conjugués des aldéhydes et des cétones, et on observe, dans ces séries, des réactions de chloro- et d'aminométhylation. Les furannes et les pyrroles sont sensibles aux agents oxydants, les thiofènes sont plus résistants à ces agents ; ils donnent parfois des produits d'oxydation au niveau du soufre (sulfones). Le pyrrole se distingue essentiellement des amines secondaires par l'acidité particulière de sa fonction NH, conséquence de la participation du doublet de l'atome d'azote à la conjugaison cyclique de la molécule. Cet atome d'hydrogène peut être remplacé par du magnésium dans la réaction du pyrrole ou de l'indole avec un organomagnésien, et le dérivé obtenu réagit facilement pour donner des produits de substitution en position-2 (pyrrole) et -1 ou -3 (indole). Les dérivés organoalcalins correspondants sont obtenus par action des métaux eux-mêmes ou de leurs amidures. Les thiofènes sont réduits par le nickel de Raney avec désulfuration : cette réaction est utilisée en synthèse pour construire de longues chaînes carbonées (réaction).
Les dérivés hydroxylés, aminés et thiohydroxylés de ces hétérocycles ont un comportement tautomère qui les distingue de la série aromatique normale (réactions).
Les pyrrolénines et indolénines sont des isomères des pyrroles et des indoles. Leur réactivité est assez différente et, en particulier, les indolénines sont plus basiques que leurs isomères indoliques.
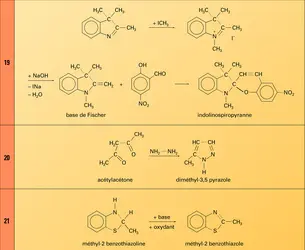
Un dérivé indolénine important est la base de Fischer obtenue par action d'une base sur un sel quaternaire de triméthyl-1, 3, 3-indoléninium et qui, par condensation avec les aldéhydes salicyliques, donne (réactions) des produits de condensation spiropyranniques jouissant de propriétés photochromes.
Hétérocycles di- ou polyhétéro-atomiques à cinq chaînons
Nomenclature et composés importants
Les cycles de base les plus importants de cette série comportent au moins un hétéroatome d'azote ; on les désigne sous le nom d'azoles.
Les hétérocycles purement azotés comprennent le diazole-1,2 ou pyrazole, le diazole-1,3 ou imidazole, le triazole-1, 2, 3 ou -1, 2, 4, le tétrazole et le pentazole.
Les principaux hétérocycles contenant deux hétéroatomes différents sont l'oxazole-1,3, l'oxazole-1,2 ou isoxazole, le thiazole-1,3, le thiazole-1,2 ou isothiazole. Les oxa- et thiadiazoles ont des nomenclatures évidentes.
Parmi les composés importants de cette série, il faut citer l'histamine responsable des allergies humaines, l'alcaloïde pilocarpine, la vitamine B1 qui contient le cycle thiazolium et le cycle pyrimidine.
Préparation
Les méthodes de synthèse dépendent du nombre et de la position relative des hétéroatomes. Parmi les méthodes générales, on peut citer les suivantes :
– lorsque les deux hétéroatomes sont en position-1,2, on condense un dérivé β-difonctionnel avec un réactif qui apporte les deux hétéroatomes (hydrazine ou diazoalcanes) pour les pyrazoles (réaction), hydroxylamine ou oxyde de nitrile pour les oxazoles. Si le réactif correspondant n'existe pas ou n'est pas stable (thiolamine par exemple), on procède à la fermeture du cycle au niveau de la liaison-1,2 par une réaction appropriée, comme l'oxydation, sur un dérivé γ-difonctionnel ;
– lorsque les deux hétéroatomes sont en position-1,3, plusieurs méthodes sont possibles ; l'une des plus connues, celle de Hantzsch, condense un dérivé carbonylé α-halogéné avec un amide (oxazoles), un thioamide (thiazoles) ou une amidine (imidazoles).
Propriétés chimiques
Les plus importants des hétérocycles à caractère aromatique sont les azoles dont les propriétés sont semblables à la fois à celles des cycles monohétéroatomiques, pyrrole, furanne, thiofène, et à celles de la pyridine. Les diazoles (pyrazole et imidazole) sont l'objet d'une protomérie. Ce sont des composés basiques par leur azote du type pyridinique, mais ils peuvent être également acides par un azote du type pyrrolique.
Les réactifs électrophiles attaquent de préférence l'atome d'azote de type pyridinique : on peut ainsi obtenir des sels quaternaires (azolium) par action d'un halogénure d'alkyle. Les réactions de substitution électrophile, caractéristiques des composés benzénoïdes, se retrouvent dans cette série de composés ; toutefois, la nitration, la sulfonation et la réaction de Friedel et Crafts, qui sont généralement réalisées en milieu acide, se produisent en fait sur l'acide conjugué (azolium) de l'hétérocycle, et sont moins rapides qu'en série aromatique homocyclique. L'orientation de ces réactions de substitution électrophile résulte d'une superposition des effets des hétéroatomes, déjà observés à propos des hétérocycles monohétéroatomiques : un azote pyridinique désactive le cycle et oriente en méta-.
En présence d'une base, les diazoles se transforment en anions très sensibles à l'attaque par un réactif électrophile. Les réactifs nucléophiles attaquent de préférence les atomes de carbone situés en α de l'hétéroatome le plus électron-attracteur. Les cations azolium sont particulièrement sensibles à l'attaque par ces réactifs ainsi que par les bases, et les réactions de ce type ont une grande importance pratique dans la synthèse des colorants sensibilisateurs chromatiques des émulsions photographiques (cyanines).
Les hétérocycles non aromatiques de ce groupe réagissent d'une manière analogue à celle de leurs homologues aliphatiques. La seule réaction particulière (réaction) qu'ils présentent est l'aromatisation par perte d'un proton (milieu basique) puis d'un ion hydrure (milieu oxydant).
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Médias
Autres références
-
ALCALOÏDES
- Écrit par Jacques E. POISSON
- 5 689 mots
- 5 médias
...catégorie définie de composés chimiques en raison de la variété de leurs structures moléculaires. Toutefois, d'une façon constante, ils possèdent un squelette hétérocyclique azoté, si l'on excepte quelques substances où l'azote est extracyclique (colchicine, éphédrine). La classification la plus accessible est... -
AROMATICITÉ
- Écrit par André JULG
- 4 707 mots
- 2 médias
De même, une molécule aromatique peut contenir des hétéroatomes. Par exemple, dans la pyridine C5H5N (formule 6), qui dérive formellement du benzène par le remplacement d'un groupement CH par un atome d'azote, c'est ce dernier qui fournit un électron au système conjugué. -
AZÉTIDINE ou TRIMÉTHYLÈNE-IMINE
- Écrit par Dina SURDIN
- 64 mots

Masse moléculaire : 57,09 g
Masse spécifique : 0,843 g/cm3
Point d'ébullition : 63 0C.
Liquide incolore, fumant à l'air, d'odeur ammoniacale, soluble en toutes proportions dans l'eau et l'éthanol.
Le cycle à quatre chaînons s'ouvre facilement ; sous l'action de l'acide...
-
AZIRIDINE ou AZACYCLOPROPANE ou DIMÉTHYLÈNIMINE
- Écrit par Dina SURDIN
- 159 mots

Masse moléculaire : 43,07 g
Masse spécifique : 0,832 g/cm3
Point d'ébullition : 56 0C
Huile à très forte odeur ammoniacale, fumant à l'air. Miscible à l'eau, soluble dans l'éthanol.
Également appelée azacyclopropane, diméthylènimine ou bien cyclodiméthylène amine, l'aziridine...
- Afficher les 20 références
Voir aussi
- ÉLECTROPHILES RÉACTIONS
- BASE, chimie
- PYRIMIDINES
- CARBONÉE CHAÎNE
- DIELS-ADLER RÉACTION DE
- CYCLIQUES COMPOSÉS
- FRIEDEL & CRAFTS CATALYSEUR DE
- CYCLISATION
- FRIEDEL & CRAFTS RÉACTIONS DE
- NUCLÉOPHILES SUBSTITUTIONS
- INDOLE NOYAU
- PYRROLE & NOYAU PYRROLIQUE
- HÉTÉROATOME
- ÉPOXYDES
- DIAZINES
- THIOFÈNE ou THIOPHÈNE
- FISCHER BASE DE
- AZOLES
- CONJUGAISON, chimie
- NOMENCLATURE, chimie
- VITAMINE H
- RÉACTIVITÉ CHIMIQUE