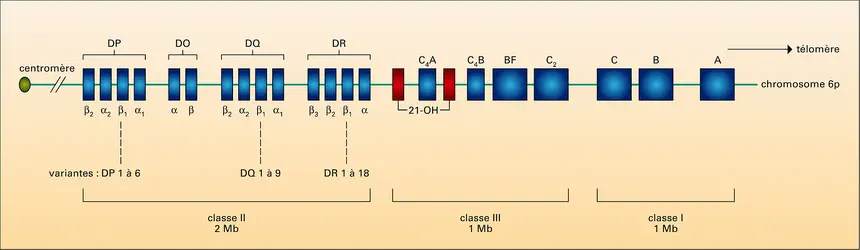
HISTOCOMPATIBILITÉ
Structure tridimensionnelle et rôle d'une molécule HLA de classe I ou de classe II dans l'activation de la réponse immunitaire
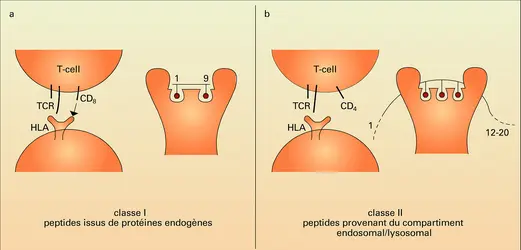
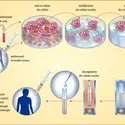
Le mécanisme par lequel le complexe d'histocompatibilité intervient dans la réponse immunitaire ne pouvait être défini avant que la structure tridimensionnelle de ses molécules ne fût résolue. Cette résolution a permis de mettre en évidence l'existence d'une poche (PBR) au sein de laquelle les peptides à caractère antigénique pourront être intimement associés (fig. 3).
Classe I
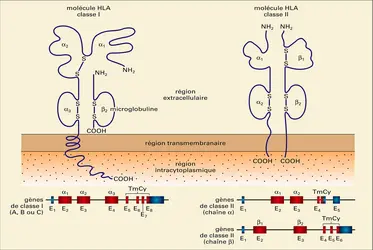
Les parties extracellulaires des molécules de classe 1 sont organisées, comme on l'a signalé plus haut, en trois domaines formant une poche ou cavité dans laquelle se logent les peptides. Cette cavité presque fermée (contrairement aux molécules de classe II) ne peut fixer que des peptides de huit à dix aminoacides (dits résidus) de longueur. En premier lieu, cette association se réalise dans la cellule qui élabore la molécule HLA, lorsque celle-ci atteint le réticulum endoplasmique, reflétant ainsi les constituants chimiques présents dans ce compartiment – principalement des produits de dégradation cellulaire et des peptides provenant de virus ou de parasites.
Lorsque, comme le montre la figure a, le peptide antigénique est présent à la surface des lymphocytes Th1, il est reconnu par les lymphocytes Tc. Ceux-ci pourront alors détruire éventuellement n'importe quelle cellule (infectée par exemple par un virus ou en parasite) présentant la même combinaison peptide-HLA.
Les cavités de toutes les molécules HLA de classe I étudiées jusqu'ici possèdent toute une série de sous-cavités correspondant à chacun des résidus peptidiques, le deuxième et le dernier acide aminé de ces peptides, « points d'ancrage », étant les plus étroitement liés et les plus hautement spécifiques. Habituellement, un acide aminé basique comme l'arginine correspond au deuxième et la leucine/isoleucine au dernier.
Classe II
La partie extracellulaire de chacune des molécules de classe II est organisée en deux domaines (quatre au total), comme ceux des immunoglobulines, et deux d'entre eux se combinent pour former l'intérieur de la cavité qui fixe le peptide. Cette cavité est ouverte, permettant ainsi la fixation de peptides de douze à vingt résidus de longueur (dans certaines conditions, on a montré que des protéines entières peuvent être logées). D'abord, l'évidence expérimentale suggère que la fixation a lieu lorsque la molécule HLA est produite et excrétée dans le cytoplasme (les molécules de classe II suivent cette voie d'expression et ne traversent pas le réticulum endoplasmique, contrairement aux molécules de classe I), traduisant ainsi la présence de constituants chimiques dans ce compartiment cellulaire, qui contient les produits de dégradation importés par endocytose, dans le sous-ensemble de cellules présentant les molécules de classe II. Puisque ce sous-ensemble comprend les cellules B avec les molécules immunoglobulines spécifiques qu'elles produisent, on s'attend à ce qu'elles aient intégré et concentré par endocytose les peptides provenant de l'antigène reconnu par ces immunoglobulines. Ensuite, comme le montre la figure b, ces peptides antigéniques étant reconnus par le récepteur TcR des lymphocytes Th1 (lorsque des co-facteurs appropriés sont présents), ceux-ci se trouvent activés. Ils reconnaissent à leur tour la même combinaison sur les cellules B qu'ils activent pour qu'elles produisent des anticorps appropriés. Ajoutons que la cavité de classe II est non seulement ouverte, mais accepte aussi une sélection de peptides beaucoup moins restreinte, compte tenu de l'absence de points d'ancrage à l'intérieur de cette cavité.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean DAUSSET : professeur honoraire au Collège de France, président de la fondation Jean Dausset-C.E.P.H.
- David GRAUSZ : biologiste moléculaire
Classification
Médias
Autres références
-
CANCER - Immunothérapie
- Écrit par Emmanuel DONNADIEU
- 5 131 mots
- 5 médias
...leurs anomalies et devenir « invisibles » aux lymphocytes T. Elles ont, par exemple, la capacité de diminuer l’expression des molécules du complexe majeur d’histocompatibilité de classe I qui présentent les antigènes tumoraux à la surface des cellules : dans ces conditions, les lymphocytes T cytotoxiques... -
DAUSSET JEAN (1916-2009)
- Écrit par Jean-Luc TEILLAUD
- 954 mots
Le Français Jean Dausset, né à Toulouse en 1916 et décédé à Palma de Majorque (Espagne) le 6 juin 2009, a révolutionné le monde de l'immunologie avec sa découverte des molécules du « complexe majeur d'histocompatibilité », une contribution essentielle pour comprendre les règles de...
-
GREFFE MÉDULLAIRE
- Écrit par Laurent DEGOS
- 768 mots
- 1 média
On définit la greffe médullaire comme la transplantation de moelle osseuse. On distingue l'autogreffe (le donneur et le receveur de la moelle osseuse sont la même personne) et l'allogreffe (donneur et receveur sont deux personnes distinctes). La greffe apporte les éléments hématopoïétiques...
-
GREFFES
- Écrit par Jean PAUPE
- 3 740 mots
- 3 médias
Tout phénomène immunologique implique une stimulation antigénique. On parlera d'histocompatibilité lorsque les constituants antigéniques du donneur et du receveur seront tels que ce dernier ne pourra pas se sensibiliser contre le greffon, et d'histo-incompatibilité lorsque la sensibilisation... - Afficher les 11 références