HORMONES
Article modifié le
Rôle des récepteurs nucléaires
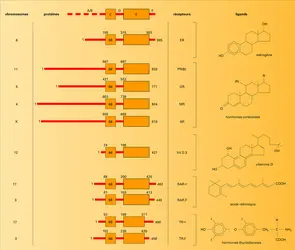
La superfamille des récepteurs nucléaires comprend les récepteurs des stéroïdes ( glucocorticoïdes, androgènes, estrogènes, progestérone et minéralocorticoïdes) de la vitamine D, des hormones thyroïdiennes, de l'acide rétinoïque (fig. 2) et des récepteurs dits « orphelins » pour lesquels les ligands ne sont pas encore connus. Ceux-ci sont localisés dans le noyau de la cellule et interagissent directement avec l'ADN.
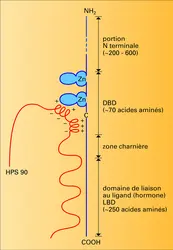
Les récepteurs nucléaires sont des protéines de grande taille (poids moléculaire compris entre 45 000 et 120 000). Leur longueur est variable : de 427 acides aminés pour le récepteur de la vitamine D 3 à 984 pour celui des minéralocorticoïdes. Ces molécules se trouvent dans le noyau des cellules cibles avant toute interaction avec l'hormone, sauf dans le cas des récepteurs des glucocorticoïdes et des minéralocorticoïdes, qui semblent localisés à la fois dans le noyau et le cytoplasme. Toutefois, après interaction avec l'hormone, toutes ces protéines se trouveront dans le noyau – lieu de leur action – liées à l' ADN avec forte affinité. Le clonage et le séquençage de leurs ADN complémentaires (ADNc) ont permis d'avancer rapidement dans la connaissance de leur structure primaire, c'est-à-dire de la séquence d'acides aminés qui les compose. De même, ces techniques ont permis d'établir rapidement des relations structure-fonction. On a ainsi pu montrer qu'il existait une grande similitude dans leur structure primaire, qui est aussi partagée par d'autres facteurs de transcription. Ainsi, bien que liant des hormones structurellement différentes, tous ces récepteurs se comportent comme des facteurs de transcription hormono-induits. De plus, des expériences de mutagenèse et de transfection de leur ADNc ont permis de définir précisément leurs différents domaines fonctionnels. La partie C terminale du récepteur comprend une séquence de près de 250 acides aminés impliquée dans la liaison de l'hormone ; elle a été désignée par la lettre E. Celle-ci est riche en acides aminés hydrophobes et forme une poche pouvant lier les stéroïdes, les hormones thyroïdiennes, l'acide rétinoïque ou la vitamine D 3. Il est intéressant de noter que les récepteurs de la progestérone, des glucocorticoïdes, des androgènes et des minéralocorticoïdes qui présentent une affinité croisée pour leurs ligands ont aussi une grande homologie de structure de la région responsable de la liaison de l'hormone. Dans cette région sont aussi situées la fonction de dimérisation (qui permet l'agencement de deux molécules de récepteurs entre elles) et une séquence responsable de l'interaction de certains récepteurs nucléaires avec une protéine de choc thermique au poids moléculaire de 90 kilodaltons appelée HSP 90. Dans leur partie centrale, tous les récepteurs nucléaires possèdent une séquence de près de 70 acides aminés riche en cystéines, qui permet la liaison à l'ADN (région C). Celle-ci est hautement conservée et permet la formation de « doigts ». Chaque doigt est stabilisé par l'interaction d'un ion zinc avec 4 cystéines (fig. 3). Cette structure en « doigts de zinc » permet à certains acides aminés d'interagir spécifiquement avec des séquences particulières d'ADN présentes dans la partie régulatrice des gènes hormono-régulés. Plus récemment, une fonction d'activation de la transcription appelée TAF-1 a été localisée dans la partie N terminale de la molécule de récepteur (région A/B). Cette région, de longueur hypervariable et très immunogénique, possède une très faible homologie entre les différents récepteurs ; elle est responsable de l'efficacité et de la spécificité dans la transduction du signal. Une fonction similaire mais induite par la liaison de l'hormone (TAF-2) est située dans le domaine de liaison de l'hormone. Dans ce domaine ainsi que dans une zone proche du domaine de liaison à l'ADN ont été identifiées des séquences codant pour des acides aminés chargés positivement et responsables de la localisation nucléaire de ces récepteurs.
Finalement, la connaissance de la structure des gènes de ces récepteurs a permis leur localisation chromosomique.
Mécanisme d'action des hormones à récepteur nucléaire
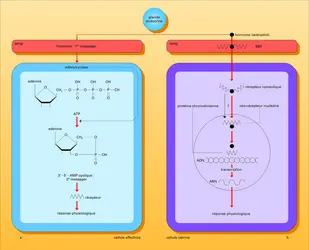
Pénétration des hormones dans les cellules. Les stéroïdes, les hormones thyroïdiennes ainsi que la vitamine D 3 pénètrent dans les cellules par diffusion passive ou facilitée. Dans les cellules cibles, ces ligands s'accumulent dans le noyau où ils seront reconnus par des récepteurs spécifiques. Dans certains tissus cibles, un métabolisme cellulaire de l'hormone transforme celle-ci en un composé plus actif, ce qui a comme conséquence une amplification du message. C'est notamment le cas de la testostérone métabolisée en dihydrotestostérone ou de la thyroxine (T4) métabolisée en une hormone thyroïdienne plus active, la triiodothyronine (T3).
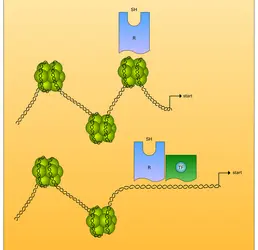
Activation des récepteurs. En l'absence de ligands spécifiques, les récepteurs nucléaires sont inactifs. L'adjonction d'hormone fait rapidement passer ces molécules vers un état actif. Ce processus est ce qu'on appelle l'activation ou la transformation. À l'état inactif, les récepteurs des hormones stéroïdes sont sous forme de complexes oligomériques associés à des protéines de choc thermique. Dans cet état, une liaison de haute affinité à des sites spécifiques d'ADN n'est pas possible (fig. 4). En présence d'hormone, une dissociation du complexe se produit, rendant possible l'interaction entre le site de liaison à l'ADN de la molécule de récepteur et certaines séquences d'ADN de la cellule cible. Cette dernière étape nécessite la dimérisation préalable de certains récepteurs. Par ailleurs, la liaison à l'hormone stabilise le récepteur sous une forme active nécessaire à la transduction du signal. Le rôle de la phosphorylation dans le maintien du récepteur dans une conformation active est toujours l'objet de controverses. Les récepteurs des hormones thyroïdiennes, de l'acide rétinoïque et probablement de celui de la vitamine D 3 se comportent différemment : leur domaine de liaison de l'hormone ne semble pas lier la HSP 90.
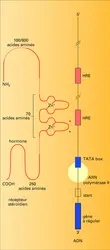
Régulation hormonale de la transcription des gènes. Les hormones stéroïdes et thyroïdiennes modifient la synthèse des protéines, principalement en induisant une augmentation de la synthèse d' ARN messager (ARNm). Ces ligands agissent sur l'initiation de la transcription de l'ARNm à partir de l'ADN des gènes hormono-régulés. Le complexe hormone-récepteur activé se lie grâce aux doigts de zinc sur l'ADN sur des séquences particulières situées dans le promoteur (partie régulatrice) des gènes cibles (fig. 5). Ces séquences sont désignées par le terme général d'« éléments de réponse aux hormones », le HRE. Il s'agit d'une famille de séquences nucléotidiques de 15 paires de bases de symétrie variable (palindromes plus ou moins parfaits) dont la délétion empêche l'induction de la transcription par le complexe hormone-récepteur. Certains promoteurs possèdent plusieurs HRE, qui peuvent avoir un effet synergique dans l'induction de la transcription. Schématiquement, chaque récepteur nucléaire se lie sous forme de dimère à des HRE spécifiques, ce qui assure la spécificité de la réponse hormonale. Cependant, la liaison récepteur HRE, bien que nécessaire, n'est pas suffisante à la modification de la transcription. La liaison de l'hormone, en modifiant aussi la conformation du récepteur, le rend apte à interagir avec d'autres facteurs de transcription nécessaires à la modification de la synthèse d'ARNm.
Mécanisme de la spécificité cellulaire de la réponse hormonale et interaction des récepteurs nucléaires avec la chromatine. Chez les eucaryotes (organismes supérieurs), contrairement aux procaryotes (bactéries), l'ADN ne se trouve pas à l'état nu, mais est localisé dans le noyau sous forme d'un complexe nucléoprotéique ayant plusieurs niveaux d'organisation, appelé chromatine. Il est donc important de comprendre que l'accessibilité des séquences régulatrices des gènes cibles aux récepteurs nucléaires ainsi qu'à d'autres facteurs de transcription solubles peut être modulée par la structure chromatinienne, et notamment par la présence des nucléosomes. Les gènes hormonorégulés sont présents dans toutes les cellules de l'organisme, et pourtant ils ne s'expriment que dans certaines d'entre elles car l'existence de récepteurs dans une cellule est la première condition à une réponse hormonale. Cependant, dans des cellules cibles différentes possédant les mêmes récepteurs, une hormone donnée pourra induire l' expression de gènes cibles différents. On suppose donc que, dans certaines cellules cibles, les structures régulatrices des gènes régulés par une même hormone sont accessibles au complexe hormone-récepteur activé, alors qu'elles sont inaccessibles dans d'autres cellules cibles. L'interaction du complexe hormone-récepteur à des HRE accessibles pourrait modifier la structure chromatinienne par un déplacement des nucléosomes (fig. 6). Cette modification rendrait possible l'interaction de facteurs de transcription, ubiquitaires ou tissus spécifiques, avec l'ADN.
Mécanisme d'action des antihormones. Les antihormones sont des molécules interférant avec les effets cellulaires des hormones. Les mieux étudiées sont les antihormones s'opposant aux effets des hormones stéroïdes. Il s'agit d' analogues structuraux ayant une affinité importante pour le récepteur concerné. La liaison de l'antihormone au récepteur empêche celle du ligand naturel, et donc l'effet biologique de celui-ci de se produire. Contrairement aux hormones naturelles et aux agonistes de synthèse, la liaison de l'antihormone au récepteur n'entraîne pas une modification conformationnelle adéquate de celui-ci ; il n'y a pas d'activation du récepteur et donc pas d'effet biologique.
Plusieurs explications – qui ne s'excluent pas entre elles – ont été proposées pour expliquer l'absence d'activation en présence d'antihormone : la liaison antihormone-récepteur pourrait entraîner une stabilisation du complexe formé par la molécule de récepteur avec les protéines de choc thermique HSP 90, HSP 70 et p59, empêchant la liaison des doigts de zinc aux HRE ; la liaison du récepteur à l'antihormone empêcherait sa dimérisation et donc la liaison à un HRE ; l'interaction du complexe antihormone-récepteur avec l'ADN pourrait être qualitativement déficiente ; le changement de conformation induit par l'antihormone empêcherait le récepteur d'interagir correctement avec d'autres facteurs de transcription nécessaires à la synthèse de novo d'ARNm.
L'intérêt des antihormones en médecine est immense. En cancérologie, ces molécules sont essentiellement utilisées dans le traitement des tumeurs malignes hormonodépendantes que sont les cancers du sein chez la femme, où l'antiestrogène tamoxifène est utilisé, ainsi que dans le cancer de la prostate chez l'homme, où l'on utilise les antiandrogènes comme l'acétate de cyprotérone. Cette dernière molécule est aussi utilisée dans le traitement symptomatique des hyperandrogénies chez la femme. L'antiprogestatif RU 486 est utilisé essentiellement dans les interruptions volontaires de grossesse (associé à une prostaglandine). Cette molécule se comporte aussi comme un antiglucocorticoïde, ce qui explique son utilisation dans certaines situations pathologiques où il existe une hypersécrétion non contrôlable de glucocorticoïdes. Finalement, les antiminéralocorticoïdes sont des diurétiques très utilisés dans le traitement des hypertensions artérielles.
Défauts génétiques des récepteurs nucléaires impliqués en pathologie
La plus spectaculaire des maladies génétiques liées à l'anomalie d'un récepteur nucléaire est celle qu'on appelait syndrome de féminisation testiculaire, bien que la dénomination de syndrome d'insensibilité aux androgènes soit plus appropriée. Il s'agit de patients génétiquement mâles (caryotype XY) mais présentant un aspect féminin. La maladie se révèle après la puberté par l'absence de règles et de pilosité. Ces malades ont des concentrations plasmatiques d'hormone mâle ( testostérone) élevées. Les testicules sont soit palpables dans les canaux inguinaux, soit intra-abdominaux. C'est l'anomalie du récepteur des androgènes qui rend compte du phénotype de ces malades. En effet, la masculinisation du sinus urogénital responsable de sa fermeture et du développement du scrotum et de la verge est sous la dépendance des hormones mâles qui ne peuvent agir qu'en présence d'un récepteur fonctionnellement intact. Depuis l'avènement de la biologie moléculaire, plusieurs altérations du gène codant pour le récepteur des androgènes responsables de ce syndrome ont été décrites. Il peut s'agir de délétions plus ou moins importantes ou de mutations ponctuelles. Celles-ci peuvent affecter le domaine de liaison de l'hormone, empêchant celle-ci de se lier au récepteur, et donc d'avoir un effet biologique. Des anomalies du domaine de liaison à l'ADN et des domaines comprenant les fonctions de transactivation ont aussi été découvertes (cf. sexualisation).
Le syndrome de résistance généralisé aux hormones thyroïdiennes se caractérise par un état d'hypothyroïdie ou d'euthyroïdie clinique associé à des concentrations élevées des hormones thyroïdiennes et de l'hormone thyréostimulante TSH. La majorité des patients ont des mutations du gène du récepteur des hormones thyroïdiennes c-erbA β localisé sur le chromosome 3. De même, les rachitismes vitamino-résistants caractérisés par des signes de rachitisme associés à des concentrations normales de vitamine D et ne répondant pas à l'administration de ce composé sont liés à des anomalies similaires du récepteur de la vitamine D 3. Des anomalies génétiques du récepteur des minéralocorticoïdes sont fortement suspectées chez des nouveau-nés présentant des syndromes de perte de sel avec hyperkaliémie malgré des concentrations élevées de l'hormone minéralocorticoïde endogène aldostérone. Cependant, elles n'ont pas été mises en évidence jusqu'à présent. Finalement, jamais un syndrome de résistance aux estrogènes ou aux progestatifs n'a été décrit.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques DECOURT : professeur honoraire de clinique endocrinologique à la faculté de médecine de Paris, membre de l'Académie nationale de médecine
- Yves-Alain FONTAINE : professeur à l'université et au Muséum national d'histoire naturelle
- René LAFONT : professeur des Universités
- Jacques YOUNG : docteur en médecine, chercheur à l'unité 33 de l'I.N.S.E.R.M., Le Kremlin-Bicêtre
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Médias
Autres références
-
NOTION D'HORMONE
- Écrit par Christiane SINDING
- 197 mots
- 1 média
À la fin du xixe siècle apparut l'idée que certaines structures anatomiques friables et très vascularisées sécrétaient des substances d'une grande importance pour l'organisme, qu'on appela « sécrétions internes », reprenant une expression inventée par Claude...
-
ADÉNYLIQUE CYCLIQUE ACIDE ou ADÉNOSINE MONOPHOSPHATE CYCLIQUE (AMP cyclique)
- Écrit par Paolo TRUFFA-BACHI
- 485 mots
En 1956, l'Américain E. W. Sutherland et ses collaborateurs découvrent un facteur thermostable indispensable à l'activation, par l'adrénaline, de la phosphorylase du tissu hépatique. La caractérisation chimique de la substance montre qu'il s'agit d'un nucléotide...
-
ADRÉNALINE
- Écrit par Jacques HANOUNE
- 3 568 mots
- 2 médias
L'exploration de la fonction médullo- surrénale est limitée, en routine, à la mesure des quantités d'hormones circulantes ou excrétées dans les urines. La sécrétion totale de noradrénaline et d'adrénaline s'élève habituellement à 10 mg/j. On dose habituellement le principal dérivé urinaire,... -
AGRESSIVITÉ, éthologie
- Écrit par Philippe ROPARTZ
- 3 932 mots
...toutes les formes d'agression n'obéissent pas au schéma simpliste élaboré vers les années quarante selon lequel toute élévation du taux des androgènes (hormones sexuelles mâles) correspond à une augmentation du niveau d'agression. Ce schéma n'est cependant pas abandonné et on explique ainsi la docilité... -
ALDOSTÉRONE
- Écrit par Pierre KAMOUN
- 1 642 mots
Dès 1934, Wintersteiner démontrait que l'animal, privé de surrénales, pouvait être maintenu en vie à l'aide d'une fraction amorphe extraite de la partie corticale de ces glandes.
En 1953, Wettstein et Reichstein ont isolé, à partir de cette fraction, une substance hormonale comportant...
- Afficher les 82 références
Voir aussi
- RÉNINE
- ANGIOTENSINE
- CORTICOSURRÉNALES
- PROMOTEUR, biologie moléculaire
- SYMPATHOMIMÉTIQUES
- TESTICULES
- TESTOSTÉRONE
- THYROÏDIENNES HORMONES
- RÉCEPTEURS NUCLÉAIRES, biochimie
- RÉTINOÏQUE ACIDE
- DOIGT DE ZINC, biochimie
- PROGESTÉRONE
- CASTRATION
- LH (luteinizing hormone) ou HORMONE LUTÉINISANTE
- ANALOGUES STRUCTURAUX
- ENDOCRINE SÉCRÉTION
- RELEASING FACTORS (RF)
- ANTÉHYPOPHYSE
- POSTHYPOPHYSE ou NEUROHYPOPHYSE
- ACTH (adrenocorticotropic hormone) ou CORTICOTROPHINE
- THYRÉOSTIMULINE (TSH)
- GONADOTROPHINES HYPOPHYSAIRES ou HORMONES GONADOTROPES
- FSH (Follicle Stimulating Hormone) ou HORMONE FOLLICULO-STIMULANTE
- ICSH (interstitial cell stimulating hormone)
- PROLACTINE ou HORMONE LUTÉOTROPE ou LTH (luteotropic hormone)
- SOMATOTROPE HORMONE (STH) ou HORMONE DE CROISSANCE ou GH (growth hormone)
- GIGANTISME
- ACROMÉGALIE
- MÉLANOTROPE HORMONE ou MSH (melanocyte stimulating hormone) ou INTERMÉDINE
- VASOPRESSINE ou HORMONE ANTIDIURÉTIQUE (ADH) ou PITRESSINE
- OCYTOCINE ou OXYTOCINE
- MYXŒDÈME
- NEUROHORMONE
- ECDYSONE
- HÉRÉDITAIRES MALADIES ou MALADIES GÉNÉTIQUES
- NEUROHYPOPHYSAIRES HORMONES
- CRÉTINISME
- PARATHORMONE
- TÉTANIE
- CORTISOL ou HYDROCORTISONE
- GLUCOCORTICOÏDES
- MINÉRALOCORTICOÏDES
- MÉDULLOSURRÉNALE
- CATÉCHOLAMINES
- OVAIRE
- PLACENTA
- ESTRADIOL ou ŒSTRADIOL
- CORTISONE
- SBP (sex steroid binding plasma protein)
- UTÉRUS
- NOYAU CELLULAIRE
- DUPLICATION, biologie moléculaire
- ARN MESSAGER ou ARNm
- TRANSCRIPTION, biologie moléculaire
- FOLLICULE OVARIEN ou FOLLICULE DE DE GRAAF
- PHOSPHOCALCIQUE MÉTABOLISME
- OSTÉOCLASTE
- STRUCTURE, biologie
- HYDRIQUE ÉQUILIBRE
- CORPS JAUNE
- CALCITONINE ou THYROCALCITONINE
- CORTICOÏDES ou CORTICOSTÉROÏDES
- GLANDES
- GONADES
- FOLLICULINE
- PHYSIOLOGIE
- DIABÈTE INSIPIDE
- SEXUELLES HORMONES
- PEPTIDIQUES HORMONES
- MÉTABOLISME DES GLUCIDES
- TRIIODOTHYRONINE (T3)
- RÉGULATION BIOLOGIQUE
- HYPERCALCÉMIE
- RÉCEPTEUR, physiologie
- CORTICOSTÉRONE
- DÉHYDROÉPIANDROSTÉRONE (DHEA)
- ANDROSTÈNEDIONE
- VITAMINE D3 ou CHOLÉCALCIFÉROL
- INVERTÉBRÉS
- CHROMATINE
- BIOSYNTHÈSES
- INSULINE
- FEEDBACK ou RÉTROACTION
- NORADRÉNALINE
- OVULATION
- LANGERHANS ÎLOTS DE
- RÉGULATION GÉNÉTIQUE
- EXPRESSION GÉNÉTIQUE
- NUCLÉOSOME
- RÉCEPTEURS HORMONAUX
- NEUROENDOCRINOLOGIE
- CALCIUM & MÉTABOLISME CELLULAIRE
- MESSAGER, biochimie
- GESTATION
- NUCLÉOTIDIQUE SÉQUENCE
- GÉNÉTIQUE MOLÉCULAIRE
- INTÉGRATION NERVEUSE & NEUROHUMORALE
- RÉGULATIONS BIOCHIMIQUES
- NEUROPEPTIDES
- SECOND MESSAGER, biologie
- PROTÉINES
- RÉCEPTEURS MEMBRANAIRES
- RÉCEPTEUR, biochimie
- TESTICULE FÉMINISANT
- PRÉGNÉNOLONE
- ECDYSTÉROÏDES
- ESTRONE ou ŒSTRONE