HYDROCARBURES
Article modifié le
Une chimie brillante
L'hydrocarbure le plus simple, ayant un atome de carbone et un atome d'hydrogène, est la molécule CH. Elle est très instable et ne survit qu'à l'état isolé, dans l'espace interstellaire en particulier.
La molécule CH2, nommée méthylène, est le prototype des carbènes, très réactifs. L'atome de carbone y porte deux électrons de valence, non liés aux hydrogènes. Selon qu'ils sont appariés ou non, le méthylène se trouve dans un état singulet ou triplet. À l'état singulet, le méthylène est coudé, avec un angle HCH de 1100. À l'état triplet, le méthylène a un angle HCH plus ouvert, 1340. L'état triplet est celui de plus basse énergie, 9 kcal.mol–1 au-dessous de l'état singulet. Les carbènes s'additionnent aux liaisons éthyléniques C=C et s'insèrent dans les liaisons C-H et C-C. En présence de catalyseurs métalliques, les carbènes peuvent se fixer à l'atome de métal : de tels complexes métalliques des carbènes servent d'intermédiaires dans une réaction remarquable, utile en pétrochimie, et dénommée métathèse. Les hydrocarbures éthyléniques, ou alcènes, sont sujets à cette réaction de coupure de la liaison éthylénique et de recombinaison des fragments carbéniques issus de cette scission.
Trois composés distincts combinent un atome de carbone et trois atomes d'hydrogène. Le cation CH3+ est de géométrie trigonale plane. Avec un électron de plus, le radical libre CH3 est pyramidal tandis qu'avec deux électrons de plus, l'anion CH3– est tétraédrique : les trois paires d'électrons de liaison C-H et la paire d'électrons non liants pointent vers les quatre sommets d'un tétraèdre centré sur le carbone.
La molécule CH4, très stable, de géométrie tétraédrique, est le méthane, principale composante du gaz naturel. Si des observateurs d'une planète lointaine le détectaient dans l'atmosphère terrestre, ils seraient fondés à en inférer la présence de la vie sur Terre. En effet, le méthane, instable vis-à-vis de sa combustion, est produit par les bactéries méthanogènes. C'est aussi l'un des gaz à effet de serre, responsables du réchauffement global. Une idée reçue de longue date est qu'un atome de carbone fixe au maximum quatre autres atomes. Or CH5+ existe bel et bien. C'est une molécule très réactive. Sa géométrie est flasque, les cinq atomes d'hydrogène se meuvent constamment, ce qui les rend équivalents en moyenne.
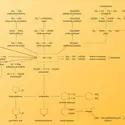
Les hydrocarbures cycliques, à commencer par les cyclanes ou cycloalcanes, ont des tensions de cycle, dénommées tension de Baeyer, du nom du chimiste allemand Adolf von Baeyer (1835-1917) qui le premier les signala. Le cyclopropane C3H6 en est un exemple (fig. 1). Le cycle y a la forme d'un triangle équilatéral. Les angles CCC mesurent donc 600, alors que la valeur naturelle de cet angle pour un atome de carbone tétracoordiné et non contraint est 1090 28'. Or la tension angulaire croît comme environ le carré de la déviation, ce qui, pour le cyclopropane, équivaut au total à 26 kcal.mol–1 de tension angulaire. La tension angulaire est du même ordre de grandeur dans le cyclobutane C4H8. Elle est d'environ 150 kcal.mol–1 dans le [3]prismane et de 185 kcal.mol–1 dans le cubane. D'environ 64 kcal.mol–1 dans le bicyclobutane, la tension angulaire est du même ordre pour le spiropentane et de 100 kcal.mol–1 dans le [3]triangulane (fig. 1). Ces valeurs sont à mettre en rapport avec l'énergie d'une liaison C-H ou C-C, une centaine de kcal.mol–1 : si la tension du cubane, au lieu d'être répartie sur l'ensemble des liaisons dans cette molécule, était focalisée sur une seule, il y aurait coupure de cette liaison.
Autre tension que montrent les hydrocarbures, celle provenant d'une éclipse. En effet, la[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre LASZLO : professeur honoraire à l'École polytechnique et à l'université de Liège (Belgique)
Classification
Médias
Autres références
-
ACÉTYLÈNE
- Écrit par Henri GUÉRIN
- 5 094 mots
- 6 médias
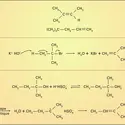
L'acétylène, de formule brute C2H2, est le premier terme des alcynes ou hydrocarbures acétyléniques de formule générale CnH2n-2. Ces derniers sont caractérisés par la présence d'une triple liaison (− C ≡ C−) dans leur molécule. L'acétylène présente une très grande...
-
ALCANES
- Écrit par Jacques METZGER
- 3 616 mots
- 11 médias
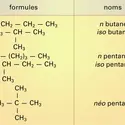
Les alcanes sont des hydrocarbures (formés uniquement de carbone et d'hydrogène) de formule générale CnH2n+2. Ils appartiennent à la série aliphatique, c'est-à-dire que leur squelette carboné ne comporte pas d'enchaînement cyclique. Ils sont saturés, car leur structure ne...
-
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 642 mots
- 4 médias
Les alcènes, encore appelés carbures éthyléniques ou oléfines, sont des hydrocarbures de formule générale CnH2n. Ils appartiennent à la série aliphatique car ils ont un squelette carboné non cyclique. Ils comportent une insaturation, c'est-à-dire que deux atomes de carbone adjacents,...
-
ALCYNES
- Écrit par Jacques METZGER
- 3 302 mots
- 5 médias
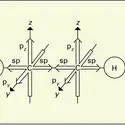
Les alcynes, encore appelés carbures acétyléniques, sont des hydrocarbures, pour la plupart aliphatiques (acycliques), dont la chaîne renferme deux carbones adjacents bicoordinés, hybrides sp. Leur formule développée fait apparaître une triple liaison entre les symboles de ces deux atomes de ...
- Afficher les 90 références
Voir aussi
- CARBÈNES
- POLYÉTHYLÈNE
- POLYPROPYLÈNE
- PROPYLÈNE
- ISOPRÈNE
- ÉTHYLÈNE
- DÉLOCALISATION ÉLECTRONIQUE
- RÉSERVES NATURELLES
- DIELS-ADLER RÉACTION DE
- CYCLIQUES COMPOSÉS
- ÉTHANE
- HYDRATES
- HÜCKEL RÈGLE DE
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- DÉCALÉE CONFORMATION
- ÉCLIPSÉE CONFORMATION
- CYCLOBUTANE
- PÉTROCHIMIE
- MÉTHYLÈNE
- TÉTRAÈDRE, stéréochimie
- CONJUGAISON, chimie
- CYCLOPROPANE
- BAEYER TENSION DE
- ADAMANTANE
- CATÉNANES
- BREDT RÈGLE DE
- ANTI-BREDT COMPOSÉS
- ANTI-AROMATICITÉ
- ANNULÈNES
- CYCLOOCTATÉTRAÈNE
- COPE TRANSPOSITION DE
- BULLVALÈNE
- CAOUTCHOUC NATUREL
- WOODWARD & HOFFMANN RÈGLES DE
- ÉNERGIE FOSSILE ou COMBUSTIBLES FOSSILES
- HYDRATES ou CLATHRATES DE MÉTHANE