- 1. Les isotopes naturels et artificiels de l’hydrogène
- 2. Le spectre de l’atome d’hydrogène et l’avènement de la mécanique quantique
- 3. Hydrogène et naissance de l’électrodynamique quantique
- 4. Structure du noyau de l’atome d’hydrogène et chromodynamique quantique
- 5. L’antihydrogène
- 6. Les phases de l’hydrogène
- 7. Hydrogène et astrophysique
- 8. Hydrogène et énergie
HYDROGÈNE (physique)
Article modifié le
L’hydrogène est l’élément le plus répandu dans l’Univers. Au début du xviie siècle, l’alchimiste genevois Turquet de Mayerne (1573-1655), poursuivant une observation de Paracelse (1493-1541), observe un dégagement de gaz lorsqu’un acide (esprit de vitriol) agit sur du fer ou du zinc. Le physicien britannique Henry Cavendish (1731-1810) est le premier à l’isoler grâce à une cloche à mercure et à l’étudier. Il le nomme « air inflammable » et, en 1766, dans un mémoire sur « les airs factices », il montre qu’il est dix fois plus léger que l’« air commun ». Le régisseur des poudres et chimiste Antoine de Lavoisier (1743-1794) lui donne son nom (issu du grec, « formeur d’eau ») en 1783, en établissant que l’eau est une combinaison de cet élément avec l’oxygène.
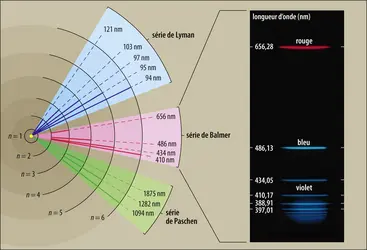
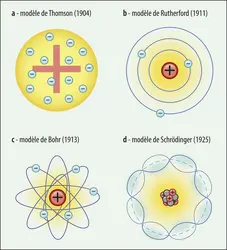
Élément le plus abondant, l’hydrogène est aussi le plus simple. Par cette simplicité – relativement à tous les autres éléments –, il permet de mettre en œuvre des expériences fondamentales pour comprendre la structure de la matière, et est devenu rapidement l’objet des tests nécessaires à l’établissement et la vérification de toute théorie physique : examiner la physique de l’hydrogène, c’est feuilleter les plus grandes pages de l’histoire de la physique moderne. Ainsi, la mécanique quantique naît et se développe dans le cadre des études du spectre de l’atome d’hydrogène. Plus tard, son déploiement en accord avec la relativité restreinte dans le cadre des théories quantiques des champs (approche théorique des interactions entre les particules) trouve certaines de ses plus brillantes confirmations dans l’étude fine de ce spectre. Enfin, la représentation des interactions nucléaires fortes par la chromodynamique quantique, introduite dans les années 1970, acquerra une reconnaissance consensuelle des physiciens des particules grâce à l’étude approfondie des interactions d’un faisceau d’électrons de haute énergie avec des noyaux d’hydrogène.
L’étude de l’hydrogène dans l’Univers est aussi un outil essentiel en astronomie. En effet, premier élément formé selon la cosmologie standard après l’explosion primordiale, il occupe des régions étendues de l’Univers sous la forme de « nuages », il initie toute l’épopée de la vie des étoiles et reste prédominant jusque dans le cœur des planètes géantes comme Jupiter. Combustible essentiel des étoiles jeunes – et du Soleil –, il permet les réactions de fusion nucléaire à l’origine de leur brillance et de toute l’énergie dispersée dans les systèmes planétaires – énergie recueillie sur Terre dans les processus de photosynthèse ou les générateurs photovoltaïques.
En physique appliquée, sous la forme de ses isotopes (deutérium et tritium), l’hydrogène participe au rêve de domestication de cette énergie de fusion auquel est dédié l’ambitieux projet ITER (fusion contrôlée) dont l’assemblage a débuté à la fin de 2020. Il est aussi un vecteur énergétique potentiellement révolutionnaire par l’intermédiaire des « piles à combustible » dont le développement industriel marque le début du xxie siècle. Enfin, son pouvoir destructeur comme charge des bombes thermonucléaires ne peut pas être passé sous silence.
Les isotopes naturels et artificiels de l’hydrogène
Il existe trois isotopes (atomes présentant le même nombre de protons et d’électrons mais pas le même nombre de neutrons) naturels de l’hydrogène. L’atome du plus fréquent (noté hydrogène 1H) a un noyau composé d’un unique proton.
Le deutérium (2H ou D, de numéro atomique 2) a été découvert en 1931 par le chimiste américain Harold Urey (1893-1981). Son noyau est composé d’un proton et d’un neutron ; très peu toxique, il n’est pas radioactif. Son abondance atomique sur Terre varie de 20 à 150 ppm (parties par millions), selon les molécules qui le contiennent,[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bernard PIRE : directeur de recherche émérite au CNRS, centre de physique théorique de l'École polytechnique, Palaiseau
Classification
Médias
Autres références
-
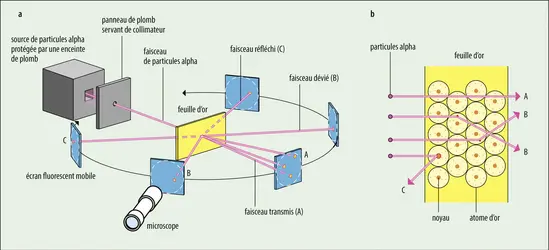
DÉCOUVERTE DE L'HYDROGÈNE PAR CAVENDISH
- Écrit par Bernard PIRE
- 728 mots
L’article envoyé en mai 1766 par l’honorable Henry Cavendish (1731-1810) à la Royal Society, dont il est membre, décrit de façon magistrale la découverte d’un gaz léger s’échappant de certaines réactions chimiques : l’hydrogène. Ces travaux, publiés dans la livraison datée du 1...
-
ACIDO-BASIQUE ÉQUILIBRE
- Écrit par Pierre KAMOUN
- 2 958 mots
- 1 média
L'apport alimentaire en ions hydrogène H+ est essentiellement représenté par les amino-acides introduits par les protéines (10 g de protéines libèrent 6 à 7 milliéquivalents d'ions H+). -
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 035 mots
- 5 médias
L'action des sels d'ammonium sur les métaux dans l'ammoniac liquide est semblable à celle des acides en phase aqueuse : on obtient un sel du métal attaqué et un dégagement d' hydrogène :
-
ARCHÉES ASGARD
- Écrit par Patrick FORTERRE
- 3 786 mots
- 3 médias
...avec une bactérie sulfato-réductrice du genre Desulfovibrio et une archée productrice du méthane du genre Methanogenium. L’archée Loki produit de l’hydrogène qui est utilisé par la bactérie pour produire du sulfure d’hydrogène et par Methanogenium pour produire du méthane. Hiroyuki Imachi... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 390 mots
- 3 médias
- Afficher les 59 références
Voir aussi
- ONDE ou RAYONNEMENT ÉLECTROMAGNÉTIQUE
- ISOTOPES
- NOYAU ATOMIQUE
- ASTROPHYSIQUE
- ANTIATOME
- RAYONNEMENT SOLAIRE
- NÉBULEUSES GAZEUSES
- SPECTROSCOPIE, astronomie
- CONFINEMENT INERTIEL
- PILE À COMBUSTIBLE
- PILE À HYDROGÈNE
- CELLULE À ENCLUMES DE DIAMANT
- FONCTION D'ONDE
- ANTIPARTICULES
- CONFINEMENT MAGNÉTIQUE
- ÉLÉMENTS CHIMIQUES
- QUANTIQUE MÉCANIQUE
- FUSION THERMONUCLÉAIRE CONTRÔLÉE
- ÉLECTRODYNAMIQUE QUANTIQUE
- BALMER SÉRIE DE
- FUSION NUCLÉAIRE
- SPECTRE, optique
- PHASES, physico-chimie
- RYDBERG CONSTANTE DE
- PHYSIQUE DES PARTICULES
- ÉNERGIE PRODUCTION D'
- PHYSIQUE HISTOIRE DE LA
- BALMER FORMULE DE
- HYDROGÈNE MÉTALLIQUE