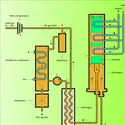
- 1. Les isotopes naturels et artificiels de l’hydrogène
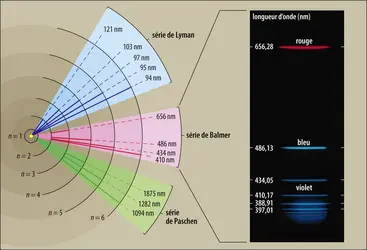
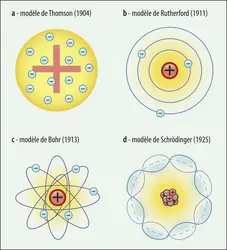
- 2. Le spectre de l’atome d’hydrogène et l’avènement de la mécanique quantique
- 3. Hydrogène et naissance de l’électrodynamique quantique
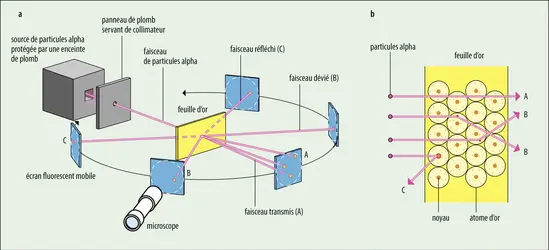
- 4. Structure du noyau de l’atome d’hydrogène et chromodynamique quantique
- 5. L’antihydrogène
- 6. Les phases de l’hydrogène
- 7. Hydrogène et astrophysique
- 8. Hydrogène et énergie
HYDROGÈNE (physique)
Les phases de l’hydrogène
L’hydrogène a été jusqu’à ce point considéré dans le cadre de l’étude d’un atome simple et des particules qui le composent. Qu’en est-il dans l’interaction d’un atome avec d’autres atomes d’hydrogène, en d’autres termes quels peuvent être les états de l’hydrogène ? Comprendre le « diagramme de phase » de l’hydrogène, c’est-à-dire ses divers états lorsqu’un échantillon est soumis à des conditions variées de température ou de pression, s’est révélé un problème physique parmi les plus difficiles, tant du point de vue théorique que du point de vue expérimental. Il s’agit en effet d’un domaine où les interactions entre les atomes voisins se conjuguent à des effets collectifs subtils mettant en jeu des nombres considérables de particules. Le problème est particulièrement ardu dans le cas des phases solides. Même les puissantes ressources informatiques utilisées par les physiciens ne leur permettent pas de prédire avec un degré de précision suffisant l’ordonnancement des atomes et le comportement des électrons dans de nombreux solides. C’est encore plus difficile dans le cas de l’hydrogène car les effets spécifiquement quantiques – c’est-à-dire des changements par sauts quantifiés – y sont plus importants.
Les états « ordinaires » de l’hydrogène.
Dans les conditions habituelles, l’hydrogène apparaît surtout sous une forme moléculaire (H2) dans laquelle deux atomes mettent en commun leurs deux électrons. Sous la pression atmosphérique normale (1 013 hPa), cette forme moléculaire est dans l’état gazeux à température normale, dans l’état liquide en dessous de 20,3 kelvins (K) et dans l’état solide en dessous de 14 K. La densité de l’hydrogène solide est de l’ordre de 76 kg/m3 et son comportement électrique est celui d’un diélectrique, c’est-à-dire qu’il peut emmagasiner de l’énergie électrostatique mais qu’il est isolant : les charges électriques qu’il contient ne peuvent pas se déplacer sur de longues distances ; l’hydrogène solide n’est donc pas conducteur. Cela se comprend par le fait qu’à des pressions inférieures à quelques gigapascals (GPa) – soit des milliards de pascals, donc des dizaines de milliers de fois la pression atmosphérique – la distance typique entre molécules reste de l’ordre de 0,4 nm soit environ cinq fois supérieure à la longueur typique de la liaison H-H dans la molécule d’hydrogène : les électrons restent liés aux molécules. À plus haute pression, on a mis en évidence cinq phases solides différentes de l’hydrogène, dont on connaît mal les structures bien qu’il semble probable que la plus grande part de l’hydrogène y reste sous une forme moléculaire (H2).
L’hydrogène métallique
Au début des années 1930, le physicien britannique John Desmond Bernal (1901-1971) avait avancé l’idée que toutes les substances deviennent métalliques lorsqu’elles sont soumises à de très hautes pressions. En 1935, le physicien hongrois naturalisé américain Eugene Wigner (1902-1995), Prix Nobel de physique en 1963 pour ses contributions essentielles au développement de la mécanique quantique, détermine par le calcul, avec son étudiant Hillard Bell Huntington (1910-1992), les propriétés métalliques qu’aurait un ensemble d’atomes d’hydrogène occupant les sites d’un réseau régulier. En examinant comment varie l’énergie d’un tel système lorsque la taille de la maille du réseau décroît, ils montrent qu’un minimum est atteint lorsque le réseau est « à corps centré » – les atomes occupent les sommets et les centres des cubes élémentaires – et que la maille a une longueur correspondant à une densité beaucoup plus élevée que celle de l’hydrogène moléculaire solide habituel. Ils en déduisent que l’hydrogène solide doit devenir métallique lorsqu’il est soumis à une pression de l’ordre de 25 GPa, c’est à dire environ 250[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bernard PIRE : directeur de recherche émérite au CNRS, centre de physique théorique de l'École polytechnique, Palaiseau
Classification
Médias
Autres références
-
DÉCOUVERTE DE L'HYDROGÈNE PAR CAVENDISH
- Écrit par Bernard PIRE
- 728 mots
L’article envoyé en mai 1766 par l’honorable Henry Cavendish (1731-1810) à la Royal Society, dont il est membre, décrit de façon magistrale la découverte d’un gaz léger s’échappant de certaines réactions chimiques : l’hydrogène. Ces travaux, publiés dans la livraison datée du 1...
-
ACIDO-BASIQUE ÉQUILIBRE
- Écrit par Pierre KAMOUN
- 2 958 mots
- 1 média
L'apport alimentaire en ions hydrogène H+ est essentiellement représenté par les amino-acides introduits par les protéines (10 g de protéines libèrent 6 à 7 milliéquivalents d'ions H+). -
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 035 mots
- 5 médias
L'action des sels d'ammonium sur les métaux dans l'ammoniac liquide est semblable à celle des acides en phase aqueuse : on obtient un sel du métal attaqué et un dégagement d' hydrogène :
-
ARCHÉES ASGARD
- Écrit par Patrick FORTERRE
- 3 786 mots
- 3 médias
...avec une bactérie sulfato-réductrice du genre Desulfovibrio et une archée productrice du méthane du genre Methanogenium. L’archée Loki produit de l’hydrogène qui est utilisé par la bactérie pour produire du sulfure d’hydrogène et par Methanogenium pour produire du méthane. Hiroyuki Imachi... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 390 mots
- 3 médias
- Afficher les 59 références