HYDROGÈNE
Article modifié le
Propriétés chimiques
L'hydrogène était déjà connu des alchimistes, qui le préparaient par action des acides sur les métaux sous le nom d'air inflammable. Cavendish fut le premier à le recueillir dans une cloche à mercure et c'est Lavoisier qui lui donna son nom.
La stabilité thermique de la molécule d'hydrogène explique sa faible réactivité à basse température. Il faut amorcer les réactions à chaud ou utiliser un catalyseur qui favorise sa dissociation.
La présence de l'unique électron sur un niveau de faible énergie (le niveau 1s à l'état fondamental) explique la valeur élevée du potentiel d'ionisation (13,6 eV) – du même ordre de grandeur que celle du krypton. La conséquence en est l'absence de composés solides contenant l'hydrogène sous forme d'ions H+. L'affinité faible, mais positive (67 kJ . mole-1), limite l'existence d'ions H- aux combinaisons avec les éléments les plus électropositifs, donc les plus faciles à ioniser. Ces remarques expliquent que, dans la plupart de ses composés chimiques, l'hydrogène possède des liaisons fortement covalentes.
Action de l'hydrogène sur les corps simples. Hydrures
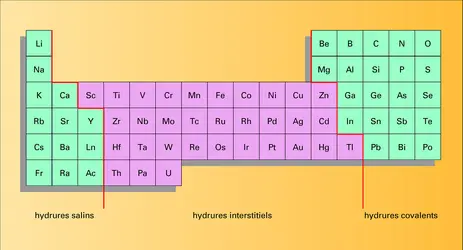
Trois classes de composés très différents peuvent se former. Leur nature est liée à la position de l'élément considéré dans le tableau périodique.
Hydrures ioniques ou salins
Correspondant aux éléments les plus électropositifs – essentiellement les alcalins et les alcalinoterreux –, les hydrures ioniques ou salins sont caractérisés par l'ion H-. L'électrolyse en milieu sel fondu donne en effet un dégagement d'hydrogène à l'anode. La forte polarisabilité de l'ion H- due au petit nombre d'électrons présents explique les variations sensibles de rayon ionique (0,144 nm dans LiH et 0,154 nm dans CsH).
On obtient ces hydrures par synthèse directe entre 200 et 500 0C. Leur structure électronique explique leur faible stabilité thermique : le seul qui ait une tension de dissociation inférieure à 1 bar au point de fusion est LiH (0,04 bar à 680 0C).
Les hydrures alcalins possèdent une structure de type NaCl, les hydrures alcalino-terreux la structure PbCl2.
L'ion H- se comporte comme une base forte : il réagit en effet avec l'eau et l'ammoniac qui sont des acides faibles avec déplacement des ions OH- et NH-2 et dégagement d'hydrogène :

Certains hydrures salins – MgH2, FeTiH2, LaNi5H6 entre autres – peuvent servir au stockage réversible de l'hydrogène dans un système énergétique où l'hydrogène serait appelé à équilibrer production et consommation. C'est le principe de la batterie « nickel-hydrogène » utilisée dans les navettes spatiales. Celle-ci se charge sous l'influence du rayonnement solaire : l'hydrogène formé à l'électrode négative par réduction de la solution aqueuse constituant l'électrolyte est absorbé par un alliage tel que LaNi5, LaNi4Cu ou TiNiZrV avec une tension de dissociation de l'ordre de l'atmosphère ; à la positive l'hydroxyde de nickel s'oxyde. L'hydrure se décompose à la décharge. L'hydrogène constitue probablement le combustible d'avenir des piles à combustibles non polluantes des véhicules terrestres.
Hydrures interstitiels
Les hydrures interstitiels se forment avec les éléments de transition. La plupart des propriétés laissent penser que l'hydrogène est à l'état d'atome non ionisé, mais ce modèle représente certainement une simplification de la réalité, qui évolue d'ailleurs d'un élément de transition à l'autre.
Tous ces hydrures ont de vastes domaines de composition : les hydrures de palladium comptent d'ailleurs parmi les premiers composés non-stœchiométriques mis en évidence. Pour des taux relativement faibles en hydrogène, les phases obtenues sont des solutions solides d'hydrogène dans le réseau du métal ; d'autres phases plus riches en hydrogène peuvent apparaître : il y en a quatre par exemple dans le système zirconium-hydrogène. Ce sont des produits friables, noirs, bons conducteurs électriques, propriétés qui les distinguent totalement des hydrures salins.
L'hydrogénation des métaux de transition suivie de déshydrogénation permet de les préparer sous une forme très divisée, qui peut accroître sensiblement leurs propriétés catalytiques.
Hydrures covalents
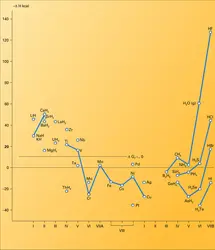
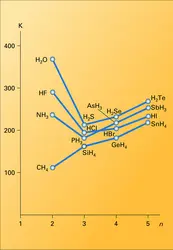
Seuls les hydrures covalents les plus stables se forment par synthèse directe. Ils caractérisent les éléments les plus électronégatifs, c'est-à-dire les éléments B de la classification périodique et les éléments des périodes courtes qui s'y rattachent. La figure montre que l' énergie de liaison croît avec l'électronégativité de l'élément associé. Les températures de fusion et d'ébullition suivent sensiblement la même évolution, si l'on excepte les anomalies de NH3, H2O et HF qui sont dues à la présence de liaisons hydrogène. La plupart des hydrures covalents sont gazeux à température ordinaire.
La combinaison de l'hydrogène avec le fluor et l'oxygène est explosive dans de larges limites de composition. Elle peut l'être également avec le chlore sous l'influence, par exemple, de radiations ultraviolettes. La synthèse de l' ammoniac :
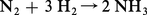
Les hydrures de bore et d' aluminium sont caractérisés par l'existence de liaisons à plusieurs centres. L'exemple type est celui du diborane B2H6 : les atomes de bore sont liés par l'intermédiaire de deux atomes d'hydrogène, chacune des liaisons B-H-B mettant en jeu trois électrons. Le rôle particulier de ces deux hydrogènes est mis en évidence par spectrométrie infrarouge, par résonance magnétique nucléaire (R.M.N.) et par l'impossibilité de les remplacer chimiquement. Malgré l'existence de ce type assez exceptionnel de liaison, dû au fait que le bore ne possède que trois électrons périphériques au lieu de quatre pour le carbone, les hydrures de bore rappellent les hydrocarbures par le nombre élevé des composés formés, la variété des structures et la facilité des interconnections.
B2H6, CH4 et SiH4 sont des réducteurs énergiques qui donnent des réactions explosives (les « coups de grisou » des mines sont dus au méthane). Au sein d'une même colonne du tableau périodique, le caractère réducteur des hydrures croît avec le numéro atomique ; c'est là une conséquence de leur stabilité décroissante. Leur caractère acide suit la même évolution (les pKa sont respectivement de 16, 7, 4 et 3 pour H2O, H2S, H2Se et H2Te).
Les éléments les plus légers sont susceptibles de donner des groupements hydrogénés généralement tétracoordonnés : BH4-, AlH4-, NH4+. Le pouvoir réducteur sélectif de BH4- et AlH4- est utilisé en chimie organique (réduction des aldéhydes, des cétones, des acides carboxyliques).
Action de l'hydrogène sur les composés minéraux
L'hydrogène est susceptible de réduire les composés minéraux lorsque ceux-ci sont thermodynamiquement peu stables et peuvent conduire à un hydrure plus stable. L'hydrogène réagira ainsi avec les oxydes, les sulfures et les halogénures des éléments les moins électropositifs :

Le pouvoir réducteur de l'hydrogène vis-à-vis des oxydes dépend du taux de vapeur d'eau présente et de la température. Comme l'énergie libre de la réaction :



Action de l'hydrogène sur les composés organiques
L'hydrogène est utilisé en synthèse organique dans les réactions les plus diverses : fixation sur les doubles liaisons, élimination d'oxygène sous forme d'eau, de chlore sous forme de gaz chlorhydrique, d'azote avec formation d'ammoniac. Ces réactions s'effectuent le plus souvent en présence de catalyseur.
L'industrie organique fait largement appel à l'hydrogène : synthèse du méthanol par action sur l'oxyde de carbone, synthèse des carburants sous pression par le procédé Fischer-Tropsch (H2 + CO), synthèse des carburants et lubrifiants par hydrogénation du charbon, durcissement et désodorisation des matières grasses alimentaires, etc.
Utilisation de l'hydrogène liquide comme constituant de propergol
L'hydrogène liquide est le combustible de fusées dont les performances sont, de loin, les meilleures : le comburant étant l'oxygène liquide, l'impulsion spécifique, pour une pression de 35 bars au sein de la chambre de combustion, atteint 365 s, au lieu de 300 au maximum pour les kérosènes. Les molécules d'eau formées lors de la combustion ont une légèreté qui assure une vitesse d'éjection élevée. Les performances pourraient encore être améliorées par l'enrichissement de l'oxygène en fluor.
Mais l'utilisation de l'hydrogène pose des problèmes de mise en œuvre considérables en raison du point d'ébullition extrêmement bas, des dangers d'explosion consécutifs à des fuites, de sa faible densité (d = 0,07) exigeant des réservoirs volumineux, de son agressivité chimique, et de la lenteur de la transformation ortho → parahydrogène.
L'emploi du couple H2 liq. + O2 liq. s'en est trouvé longtemps limité aux étages supérieurs des fusées les plus puissantes. Cette époque est aujourd'hui révolue : ce propergol permet avec une masse de 120 tonnes (dont plus de 20 p. 100 H2 liq.) le fonctionnement du principal moteur d'Ariane 5. H2 liq. en assure le refroidissement. L'hydrogène liquide est incontestablement le combustible d'avenir des fusées spatiales.
L'ion H+
En raison de l'énergie nécessaire à la rupture des liaisons covalentes X − H et du potentiel d'ionisation élevé de l'hydrogène, l'ion H+ n'existe que dans les solvants polaires suffisamment ionisants et dans lesquels il comporte une forte énergie de solvatation. La solvatation est facilitée en fait par la très petite taille du proton.
Dans l'eau par exemple :

Les ions H+ sont essentiellement solvatés sous forme H3O+.
L'équilibre H3O+ ⇆ H2O + H+ correspond à une constante de dissociation égale à 10-1,7.
Selon la définition de Brönsted un acide est d'autant plus fort qu'il libère en solution une fraction plus importante d'ions H+. Le caractère acide s'exprime ainsi par le cologarithme décimal de l'activité des ions H+ (− log[H+]), qui est encore appelé le pH. Le pH d'une solution normale d'un acide fort est égal à 0, celui de l'eau pure à 25 0C à 7. L'ion H3O+ existe également à l'état solide, où il se substitue souvent au groupement ammonium NH4+, dans (NH4)1-x(H3O)xClO4 par exemple.
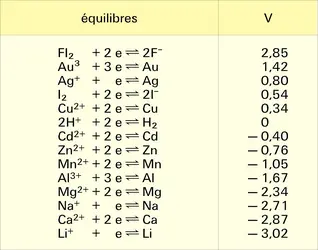
Les ions H+ sont des oxydants vis-à-vis des métaux les plus électropositifs.
Le couple 2 H+ + 2e- ⇌ H2 est caractérisé par un potentiel normal d'oxydo-réduction E0 égal à :

Liaison hydrogène et liaisons à plusieurs centres
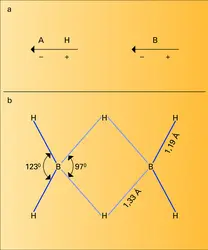
La liaison hydrogène se forme entre un groupement porteur d'un atome d'hydrogène AH et un accepteur de proton B, appartenant ou non à la même molécule s'il s'agit de composés organiques. A est un atome d'azote ou d'oxygène, B un atome d'azote, d'oxygène, de soufre ou un halogène. Bien que beaucoup moins énergétique que la liaison covalente normale, elle influence sensiblement les propriétés des liquides grâce aux associations qu'elle entraîne, elle assure la stabilité de nombreux édifices solides (la glace par exemple). C'est elle qui permet la dissociation dans l'eau des molécules covalentes hydrogénées par formation d'ions H3O+ :
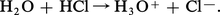
L'hydrogène participe dans certaines molécules (composés hydrogénés du bore ou de l'aluminium en particulier) à des liaisons à plusieurs centres. C'est ainsi que dans le diborane B2H6 les deux atomes de bore sont liés par l'intermédiaire de deux hydrogènes, les deux liaisons à trois centres qui en résultent sont assurées par trois électrons. Ce type de liaison est limité toutefois aux éléments légers : comme le montre la théorie des orbitales moléculaires les fonctions d'onde conjuguées doivent avoir des niveaux d'énergie voisins du niveau fondamental 1 s de l'hydrogène.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Paul HAGENMULLER : professeur à la faculté des sciences de Bordeaux, directeur du Laboratoire de chimie du solide au C.N.R.S.
Classification
Médias
Autres références
-
DÉCOUVERTE DE L'HYDROGÈNE PAR CAVENDISH
- Écrit par Bernard PIRE
- 728 mots
L’article envoyé en mai 1766 par l’honorable Henry Cavendish (1731-1810) à la Royal Society, dont il est membre, décrit de façon magistrale la découverte d’un gaz léger s’échappant de certaines réactions chimiques : l’hydrogène. Ces travaux, publiés dans la livraison datée du 1...
-
ACIDO-BASIQUE ÉQUILIBRE
- Écrit par Pierre KAMOUN
- 2 958 mots
- 1 média
L'apport alimentaire en ions hydrogène H+ est essentiellement représenté par les amino-acides introduits par les protéines (10 g de protéines libèrent 6 à 7 milliéquivalents d'ions H+). -
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 035 mots
- 5 médias
L'action des sels d'ammonium sur les métaux dans l'ammoniac liquide est semblable à celle des acides en phase aqueuse : on obtient un sel du métal attaqué et un dégagement d' hydrogène :
-
ARCHÉES ASGARD
- Écrit par Patrick FORTERRE
- 3 786 mots
- 3 médias
...avec une bactérie sulfato-réductrice du genre Desulfovibrio et une archée productrice du méthane du genre Methanogenium. L’archée Loki produit de l’hydrogène qui est utilisé par la bactérie pour produire du sulfure d’hydrogène et par Methanogenium pour produire du méthane. Hiroyuki Imachi... -
ASTROCHIMIE
- Écrit par David FOSSÉ et Maryvonne GERIN
- 4 390 mots
- 3 médias
- Afficher les 59 références
Voir aussi
- ÉLECTRONÉGATIVITÉ
- HYDROGÈNE LIAISON
- ÉLECTROSTATIQUE
- ISOTOPES
- IONISATION
- MINÉRALE CHIMIE
- FORCE D'UN ACIDE ou D'UNE BASE
- POTENTIEL D'OXYDORÉDUCTION
- SOLVATATION
- HYDRURES
- DIBORANE
- CHIMIQUES INDUSTRIES
- COVALENTE LIAISON
- ALCALINS
- GAZ À L'EAU
- PROPULSION SPATIALE
- RÉDUCTEUR, chimie
- ENTHALPIE
- PROPERGOLS
- EAU LOURDE (oxyde de deutérium)
- HYDRURE DE LITHIUM
- ÉNERGIE DE LIAISON
- pH
- CONVERSION, chimie
- TRANSITION MÉTAUX DE
- ALLOTROPIE
- STABILITÉ, chimie
- HYDROGÈNE LIQUIDE
- POTENTIEL D'IONISATION