HYDROQUINONE
Benzène-1,4-diol ou paradiphénol C6H4 (OH)2.
Masse moléculaire : 110,11 g
Masse spécifique : 1,358 g/cm3
Point de fusion : 170,5 0C
Point d'ébullition : 286,2 0C.
Composé dimorphe : cristallise en prismes hexagonaux incolores après recristallisation dans l'eau, ou en feuilles monocliniques. Soluble dans l'eau surtout à chaud, très soluble dans l'éthanol et l'éther, légèrement soluble dans le benzène.
L'hydroquinone s'oxyde très facilement. La préparation la plus courante consiste dans la réduction de la quinone. On l'utilise pour le développement des négatifs en photographie ; c'est aussi un réactif très sensible pour déceler de petites quantités de phosphates ; enfin, c'est un antioxydant.
L'hydroquinone est très toxique, provoquant des irritations locales ; son absorption en grande quantité peut entraîner la mort. Peu biodégradable et toxique pour les poissons, elle est dangereuse pour les écosystèmes, en particulier pour les eaux.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Dina SURDIN : auteur
Classification
Autres références
-
ANTIOXYGÈNES
- Écrit par Robert PANICO
- 2 341 mots
- 2 médias
On peut utiliser les antioxygènes, en particulier l' hydroquinone, pour assurer la stabilisation des monomères vinyliques dont l'autoxydation conduirait à la formation de peroxydes susceptibles d'amorcer prématurément la polymérisation. -
IONS ÉCHANGEURS D'
- Écrit par Robert ROSSET
- 6 110 mots
- 13 médias
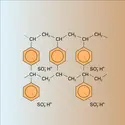
...oxydoréductrices sont des résines qui comportent un groupement capable de réaliser une oxydation ou une réduction. On connaît, par exemple, une résine à groupements hydroquinone capable de réduire l'oxygène dissous dans l'eau (lequel est responsable de la corrosion des alliages ferreux). Pour être hydrophiles,...