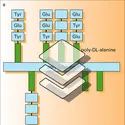
- 1. Paramètres de la réaction épitope (ou haptène)-site anticorps
- 2. Forces moléculaires de liaison impliquées dans la réaction antigène-anticorps
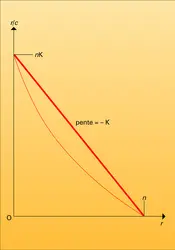
- 3. Affinité des anticorps
- 4. Réactions de précipitation (immunoprécipitation)
- 5. Immunoanalyse par les méthodes immunoenzymologiques
- 6. Réactions d'agglutination
- 7. Bibliographie
IMMUNOCHIMIE
Article modifié le
Forces moléculaires de liaison impliquées dans la réaction antigène-anticorps
Les mesures thermodynamiques montrent que la combinaison site antigénique (ou haptène)-site anticorps est réversible et implique une énergie de liaison d'environ 34 à 65 kilojoules/mole. Ces données éliminent d'emblée des liaisons covalentes (mise en commun d'électrons périphériques entre atomes) dont l'énergie varie entre 210 et 500 kJ . mol-1. Dans la réaction Ag-Ac, les forces de liaison sont uniquement des interactions « faibles » non covalentes dont quatre types différents contribuent à des degrés divers (variables selon les systèmes et assez mal définis) à l'union Ag-Ac. Ces forces sont les suivantes : interactions ioniques, interactions de Van der Waals, liaisons hydrogènes et interactions hydrophobes.
Ces forces sont les mêmes que celles qui assurent la stabilisation des configurations tridimensionnelles et quaternaires des protéines et autres macromolécules biologiques, ainsi que l'association stéréospécifique de ligands avec ces macromolécules (couples substrat-enzyme, oses-lectines, et plus généralement effecteur-récepteur...).
Contrairement aux liaisons covalentes, les liaisons non covalentes dont l'énergie moyenne varie selon les types mentionnés d'environ 4,2 à 30 kJ . mol-1 se forment et se rompent en permanence aux températures intéressant le biologiste (290-310 K). Ces énergies sont en effet de peu supérieures à l'énergie cinétique moyenne (∼ 2,5 à 3,3 kJ . mol-1) à ces températures (agitation thermique), et cette caractéristique rend compte de la réversibilité de la réaction Ag-Ac (ligand-récepteur plus généralement), c'est-à-dire de l'équilibre entre le complexe Ag-Ac et les formes libres. Il s'ensuit que la spécificité de la réaction, c'est-à-dire la stabilité du complexe, ne sera possible que par la mise en jeu simultanée d'un nombre suffisant d'interactions élémentaires. L'affinité du site anticorps reflétera donc ce nombre et leur répartition spatiale la plus appropriée pour assurer la meilleure complémentarité possible dont la réalité physique (« emboîtement » des entités réagissantes) a été démontrée par l'étude par diffraction aux rayons X.
Caractéristique fondamentale, toutes les forces non covalentes agissent à des distances interatomiques très faibles. Elles sont d'autant plus fortes (attraction) que la distance entre les groupes réagissants est plus courte (donc complémentarité plus étroite) jusqu'à la limite où des forces de répulsion entrent en jeu à l'approche du rayon de Van der Waals en raison de l'interpénétration des couches électroniques externes des atomes en contact.
Les interactions hydrophobes appelées également apolaires sont particulièrement importantes dans la réaction Ag-Ac et fourniraient jusqu'à environ 50 p. 100 de la force totale de liaison. Elles concernent l'attraction entre groupements non polaires hydrophobes (cas des chaînes latérales de certains acides aminés aliphatiques ou aromatiques). Ceux-ci ont spontanément tendance, en milieu aqueux, à adopter une disposition qui leur permet de se soustraire à cet environnement en s'associant en une structure excluant les molécules d'eau. Le processus endothermique (ΔG < 0) se traduit par une réduction de l'énergie interne du système avec augmentation concomitante de l'entropie et, de ce fait, création d'une force attractive. À l'inverse de ce qu'on observe pour la formation d'une liaison hydrogène, le terme enthalpique est plutôt positif : alors qu'une élévation de température tend à rompre les liaisons hydrogènes, elle stabilise au contraire les interactions hydrophobes. La contribution de ces interactions, calculée d'après l'augmentation de l'entropie qui accompagne[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Joseph ALOUF : membre titulaire de l'Académie nationale de pharmacie, professeur honoraire à l'Institut Pasteur, Paris, directeur de recherche honoraire au C.N.R.S., professeur à l'Institut Pasteur de Lille
Classification
Médias
Autres références
-
ALLERGIE & HYPERSENSIBILITÉ
- Écrit par Bernard HALPERN , Georges HALPERN , Salah MECHERI et Jean-Pierre REVILLARD
- 12 577 mots
- 2 médias
Lesétudes immunologiques ont montré que la spécificité antigénique est souvent l'attribut d'une petite fraction de la molécule. Le développement de la chimiosynthèse au cours des dernières décennies a permis de jeter quelque lumière sur la nature du déterminant antigénique et de sa spécificité grâce... -
ANTICORPS MONOCLONAUX
- Écrit par Michel MAUGRAS et Jean-Luc TEILLAUD
- 2 138 mots
Les anticorps, ou immunoglobines, sont des protéines sécrétées par une famille de cellules, les lymphocytes, dont la principale propriété est de reconnaître le « non-soi ». Les substances chimiques reconnues comme étrangères, qu'elles soient des associations de molécules ou des molécules,...
-
ANTIGÈNES
- Écrit par Joseph ALOUF
- 7 384 mots
- 5 médias
Enrègle générale, les antigènes sont des macromolécules, mais toute macromolécule n'est pas obligatoirement immunogène. L'immunogénicité d'une macromolécule est d'autant plus élevée que sa taille est plus importante. Exceptionnellement, un certain nombre de molécules de faible taille moléculaire... -
ÉLECTROPHORÈSE
- Écrit par Jean GUASTALLA , Jean MORETTI et Jean SALVINIEN
- 4 742 mots
- 10 médias
On a décrit plusieurs procédés qui permettent de séparer des groupes de protéines (albumine, α1, α2, β1, β2, γ-globulines) en vue depréparer ces fractions à partir, par exemple, d'un sérum. À cet effet, on utilise des portoirs de grandes dimensions dans lesquels on met une pâte d'amidon,... - Afficher les 11 références
Voir aussi
- ENZYMES
- HYDROPHOBE LIAISON
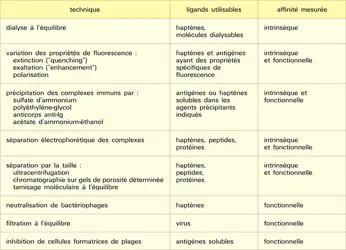
- DIALYSE À L'ÉQUILIBRE
- IMMUNOÉLECTROPHORÈSE
- FLUORESCENCE
- GÉLOSE ou AGAR-AGAR
- DIFFUSION
- COMPLÉMENT, immunologie
- ÉQUILIBRE, chimie
- PRÉCIPITATION, chimie
- THERMODYNAMIQUE CHIMIQUE
- ÉNERGIE DE LIAISON
- DOSAGE, biologie et médecine
- ENTHALPIE LIBRE ou ÉNERGIE LIBRE DE GIBBS
- ANTICORPS
- HAPTÈNE
- AGGLUTINATION, immunologie
- IMMUNOGLOBULINES
- IMMUN-SÉRUM ou ANTISÉRUM
- LIAISONS BIOCHIMIQUES FAIBLES
- RÉACTION IMMUNITAIRE
- ÉPITOPES ou DÉTERMINANTS ANTIGÉNIQUES
- CONSTANTE D'ÉQUILIBRE, chimie
- IMMUNOENZYMOLOGIE
- COMPLEXE IMMUN
- MARQUAGE, biotechnologie