- 1. Paramètres de la réaction épitope (ou haptène)-site anticorps
- 2. Forces moléculaires de liaison impliquées dans la réaction antigène-anticorps
- 3. Affinité des anticorps
- 4. Réactions de précipitation (immunoprécipitation)
- 5. Immunoanalyse par les méthodes immunoenzymologiques
- 6. Réactions d'agglutination
- 7. Bibliographie
IMMUNOCHIMIE
Article modifié le
Affinité des anticorps
L 'affinité des anticorps se conçoit comme la résultante des forces attractives et répulsives établies entre les anticorps et les épitopes homologues de l'antigène correspondant ou avec des haptènes (Steward). La nature même de la réaction Ag-Ac amène à distinguer, d'une part, au niveau élémentaire l'affinité intrinsèque d'un anticorps individuel pour la structure homologue qu'il reconnaît (interaction primaire) et, d'autre part, l'affinité fonctionnelle (terme proposé par Karush de préférence à « avidité des anticorps » antérieurement utilisé) qui concerne l'interaction globale de l'ensemble bi- ou multivalent et hétérogène de la population d'anticorps (cf. infra, Affinité fonctionnelle), avec les différents épitopes de l'antigène. L'affinité fonctionnelle est toujours supérieure à la somme des affinités intrinsèques du système. Ce phénomène d'amplification parfois considérable (facteur 100 ou 1 000) analysé plus loin résulte de la multivalence des molécules réagissantes.
Affinité intrinsèque
Considérons l'interaction individuelle entre un haptène monovalent libre ou un épitope naturel ou hapténique d'un antigène, que nous désignerons indistinctement par le terme de ligand L, et un site anticorps d'une molécule d' immunoglobuline donnée, ou son fragment monovalent Fab, que nous appellerons indistinctement P. La réaction entre les deux entités L et P est réversible et peut se représenter par l'équation :


Lorsque l' équilibre est atteint, la vitesse est nulle, il se forme autant de molécules de complexes qu'il s'en dissocie (l'équation 2 = 0) d'où la relation (loi d'action de masse) :

La constante d'équilibre K, appelée aussi constante d'association intrinsèque, est, par définition, l'affinité intrinsèque de l'anticorps. Celle-ci a donc une définition thermodynamique quantitative précise. K, dénoté parfois Ka, a les dimensions d'un inverse de concentration, et s'exprime donc en litre/mole (L mol-1 ou M-1). Notons que l'équation (3) indique que deux réactions réversibles peuvent avoir une constante K identique mais des constantes de vitesse différentes. Certains auteurs expriment l'équilibre de la réaction (1) par le rapport :

Plus K sera élevé, meilleure sera l'affinité de l'anticorps et donc la stabilité du complexe LP. Les valeurs de K varient entre 105 (faible affinité) à 109 (forte affinité) et même 1012 L mol-1. Il est important de souligner qu'à part les anticorps monoclonaux dont l'affinité est homogène (valeur unique) la plupart des anticorps spécifiques d'un ligand, fût-il un haptène très simple, forment une population hétérogène (entre autres types d'hétérogénéité) ayant un spectre variable d'affinité. L'affinité mesurée selon l'équation (3) sera une affinité intrinsèque moyenne, K0, qui est la moyenne des constantes d'association intrinsèque de chacun des anticorps formant cette population de molécules.
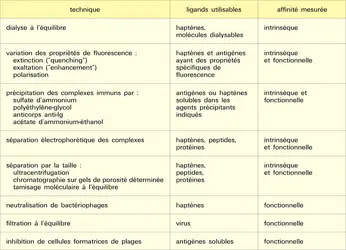
On peut observer d'après l'équation (3) que, si à une quantité fixe d'anticorps on ajoute des quantités croissantes de ligand, on obtiendra, pour une certaine quantité de ligand, un mélange en équilibre dans lequel la moitié des sites anticorps sont occupés par le ligand. Dans ce cas [LP] = [P] et K ou Ka = 1 [L]. En d'autres termes, l'affinité est égale à l'inverse de la concentration en ligand libre quand la moitié des sites anticorps est occupée. Les techniques expérimentales de mesure de l'affinité intrinsèque figurent au tableau et seront décrites plus loin dans le cadre des réactions primaires Ag-Ac.
Aspects thermodynamiques de la réaction ligand-site anticorps
La formation du complexe L − P de la réaction (1) entraîne une variation de l' énergie libre standard ΔG0 du système reliée à la constante d'équilibre K par l'équation :



En déterminant K à deux températures différentes T1 et T2, on peut calculer ΔH comme suit :


L'équation (6) montre que la variation d'énergie libre ΔG0 résulte de la contribution des paramètres enthalpique et entropique. Selon les systèmes Ag-Ac, l'un ou l'autre de ces paramètres prédomine.
Lorsque la variation d'enthalpie est nulle, le terme entropique est dominant, ce qui suggère que les liaisons impliquées sont essentiellement des liaisons hydrophobes (réarrangement de molécules d'eau autour du complexe LH). Lorsque la variation d'enthalpie est prépondérante, les liaisons sont d'un tout autre type. Il s'agira principalement de liaisons hydrogène et ioniques.
Techniques de mesure des interactions primaires antigène-anticorps ou haptène-anticorps
De nombreuses techniques physiques permettent la mesure de l'affinité intrinsèque et donc l'interaction primaire. Elles sont pour la plupart basées sur la séparation des molécules de ligand libre et de ligand lié aux anticorps sans toutefois perturber l'équilibre représenté par l'équation (3). Le système expérimental consiste à incuber à une température donnée une quantité fixe d'anticorps et des concentrations croissantes de ligand. On attend l'établissement de l'équilibre et on détermine par un dosage approprié soit la concentration du ligand libre [L] et lié [LP] (ce qui est le plus facile dans la plupart des systèmes et des techniques), soit la concentration des anticorps libres [P] et liés [PL].
Le calcul de K (d'après la loi d'action de masse, équation 3) utilise les données suivantes : M = concentration en anticorps (moles/litre) ;
– c = concentration de ligand libre à l'équilibre (moles/litre) ;
– n = nombre total de sites par molécule d'anticorps (valence de l'anticorps) ;
– r = nombre moyen de sites ayant fixé le ligand dans des conditions d'équilibre : nombre de molécules du ligand lié par molécule d'anticorps.
Dans l'hypothèse où les sites de la molécule d'anticorps sont équivalents (même valeur de K) et indépendants, c'est-à-dire que la fixation d'un ligand sur un site ne modifie pas l'affinité des autres sites (absence d'effet coopératif positif ou négatif) et pour une population d'anticorps d'affinité unique (monoclonaux), l'équation (3) pourra s'écrire :


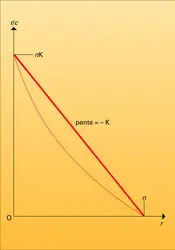
À partir des valeurs expérimentales de r et c, on peut calculer K et n en utilisant un graphe approprié de ces équations mises sous forme d'une relation du premier degré. Une des représentations les plus utilisées est celle de Scatchard qui exprime r/c en fonction de r :

La droite représentative de cette équation a pour pente − K. Son intersection avec l'axe des abscisses permet de calculer la valence n de l'anticorps (r/c = 0 pour r = n correspondant à une concentration en ligand → ∞).
La linéarité de cette fonction (12) n'est observée expérimentalement que dans le cas idéal des anticorps monoclonaux, car leur affinité est homogène. Dans les autres cas, on observe une allure non linéaire des courbes expérimentales, due à l'hétérogénéité du point de vue affinité de la population d'anticorps qui se lie au ligand. Cette déviation sera d'autant plus importante que le spectre des affinités sera plus large. On pourra seulement alors estimer, à partir des données, une valeur K0 moyenne, qui se calcule d'après les graphes pour la concentration en ligand où la moitié des sites anticorps sont liés (r = r′ d'où K0 = 1/c c'est-à-dire l'inverse de cette concentration).
Les mesures les plus aisées et les plus précises pour le calcul de K ou de K0 ont été obtenues avec des haptènes, en raison de la faible taille de ces ligands (monovalents le plus souvent) et du fait qu'ils peuvent être aisément dosés sous leur forme libre ou liée, par radioactivité ou par spectrophotométrie. Parmi les techniques physiques citées dans le tableau, la dialyse à l'équilibre et le blocage de la fluorescence sont les plus usuelles.
La dialyse s'effectue dans une cellule de dialyse comprenant deux compartiments séparés par une membrane semi-perméable. Les anticorps ne sont ajoutés que dans l'un des deux compartiments. Les haptènes se répartissent entre les deux compartiments et atteignent une distribution d'équilibre caractéristique entre ces deux compartiments. La concentration d'haptènes libres est la même des deux côtés de la membrane mais, du côté où se trouvent les anticorps, il y a, en plus, les haptènes liés aux anticorps. On détermine les valeurs de r pour différentes valeurs de c, à une ou plusieurs températures. Le temps nécessaire pour atteindre l'équilibre est assez long (de 1 à 2 jours), mais cela est dû uniquement à la lenteur de l'équilibration à travers la membrane, car la combinaison avec l'anticorps est pratiquement instantanée (fraction de seconde).
Le blocage de la fluorescence se base sur la mesure de la baisse de fluorescence des résidus tryptophanyl des anticorps dans les complexes formés avec le ligand (à condition que la bande d'absorption de celui-ci chevauche avec la bande d'émission de tryptophane, environ 350 nm).
Pour les ligands macromoléculaires, on a recours aux techniques de précipitation au sulfate d'ammonium (méthode de Farr), ou au moyen d'autres agents précipitants, dans des conditions où l'antigène libre (souvent marqué par une radio-isotope, notamment l'iode 125) reste en solution alors que les complexes Ag-Ac et les anticorps libres sont précipités.
Affinité fonctionnelle
Les interactions définies dans les paragraphes précédents ne concernaient que la liaison d'un ligand et d'un site anticorps, qui a permis une définition précise de l'affinité à ce niveau élémentaire d'interaction. Cependant, sauf exception, la réaction Ag-Ac est un processus impliquant simultanément l'interaction de molécules d'anticorps bivalentes (IgG, IgE) ou multivalentes (IgA, IgM) avec des antigènes multiépitopiques donc multivalentes. Cette réaction peut s'écrire symboliquement :

En raison de cette double multivalence, il est impossible de définir une constante d'association globale des anticorps permettant d'évaluer quantitativement l'ensemble des forces mises en jeu pour former le complexe. Pendant longtemps le concept d'avidité avait prévalu comme reflet de cette affinité globale. On pouvait évaluer grossièrement l'avidité d'un immunsérum en étudiant l'effet de la dilution sur un mélange d'antigène et d'immunsérum, ce qui a pour effet de réduire la concentration d'antigène et d'anticorps libre et donc de dissocier le complexe.
Une série d'observations expérimentales étayées par diverses approches théoriques a permis d'aboutir au concept d'affinité fonctionnelle, qui traduit le fait que l'affinité d'une molécule d'anticorps bivalente (IgG, IgE) ou multivalente (IgA, IgM) n'était pas égale à la somme arithmétique de l'affinité de chaque site considéré séparément, mais beaucoup plus élevée, souvent par plusieurs ordres de grandeur (102 à 106). En d'autres termes, une stabilité supplémentaire est conférée à un complexe Ag-Ac lorsque la molécule d'anticorps réagit avec plus d'un déterminant. Ce renforcement a été observé aussi bien pour une molécule d'anticorps reliant deux épitopes sur deux molécules d'antigène ou des épitopes répétitifs (liaison monogame) présents sur une même molécule (antigènes polyosidiques) ou sur une même structure (motifs hapténiques répétitifs, épitopes à la surface de cellules ou de capsides virales). L'affinité fonctionnelle, terme qui doit être utilisé de préférence à celui d'avidité, dépend évidemment de l'affinité intrinsèque des sites anticorps, mais implique aussi la contribution d'autres facteurs, tels les valences de l'antigène et de l'anticorps. Différents autres paramètres, non liés directement à l'interaction primaire entre sites, anticorps et épitopes, sont également impliqués dans ce phénomène d'amplification, tels l'amplitude de l'écartement de la région charnière des molécules d' immunoglobulines et, vraisemblablement, différentes conformations topologiques. La réalité de cette amplification de l'affinité a pu être apportée par la mesure comparée de l'affinité de fragments monovalents (Fab) d'IgG ou d'IgM par rapport à celle des molécules intactes.
Les implications biologiques de l'affinité fonctionnelle sont très importantes sur le plan de l'immunité anti-bactérienne ou anti-virale et pour les réactions de stimulation à point de départ membranaire (cellules lymphoïdes, cellules tumorales...). Elle peut expliquer la remarquable activité biologique in vivo à très faible concentration des anticorps dirigés contre les micro-organismes, souvent porteurs de motifs répétitifs.
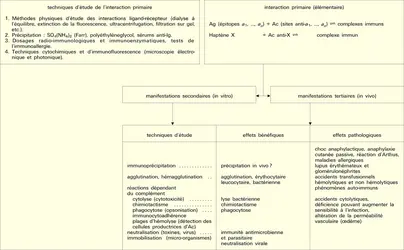
Les interactions primaires (étudiées ci-dessus) ne prennent en compte que les réactions entre les molécules d'antigènes et les anticorps homologues indépendamment des effets physicochimiques et biologiques (y compris leurs manifestations macroscopiques) qui en découlent. Ces réactions dépendent uniquement de la quantité et de l'affinité des anticorps.
Les manifestations secondaires des interactions primaires sont nombreuses. Les phénomènes d'immunoprécipitation, d'agglutination et les réactions impliquant le complément, pour ne citer que les plus courants bien que traduisant les réactions élémentaires sites anticorps-épitopes, ont des caractéristiques propres indépendantes de cette interaction. Ainsi, certains anticorps donnent bien lieu à des précipités ; mais d'autres ne présentent pas cette propriété. Les réactions d'agglutination sont 50 à 100 fois moins sensibles pour les IgG que pour les IgM. Les IgA et les IgE qui ne fixent pas le composant C1q du système complément n'interviennent pas dans les phénomènes de cytolyse impliquant la participation de ce système. L'utilité des réactions secondaires est toutefois considérable pour l'analyse qualitative et quantitative des antigènes et des anticorps et de la réaction Ag-Ac, notamment pour ce qui est des réactions de précipitation, des réactions immunoenzymatiques et des réactions d'agglutination.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Joseph ALOUF : membre titulaire de l'Académie nationale de pharmacie, professeur honoraire à l'Institut Pasteur, Paris, directeur de recherche honoraire au C.N.R.S., professeur à l'Institut Pasteur de Lille
Classification
Médias
Autres références
-
ALLERGIE & HYPERSENSIBILITÉ
- Écrit par Bernard HALPERN , Georges HALPERN , Salah MECHERI et Jean-Pierre REVILLARD
- 12 577 mots
- 2 médias
Lesétudes immunologiques ont montré que la spécificité antigénique est souvent l'attribut d'une petite fraction de la molécule. Le développement de la chimiosynthèse au cours des dernières décennies a permis de jeter quelque lumière sur la nature du déterminant antigénique et de sa spécificité grâce... -
ANTICORPS MONOCLONAUX
- Écrit par Michel MAUGRAS et Jean-Luc TEILLAUD
- 2 138 mots
Les anticorps, ou immunoglobines, sont des protéines sécrétées par une famille de cellules, les lymphocytes, dont la principale propriété est de reconnaître le « non-soi ». Les substances chimiques reconnues comme étrangères, qu'elles soient des associations de molécules ou des molécules,...
-
ANTIGÈNES
- Écrit par Joseph ALOUF
- 7 384 mots
- 5 médias
Enrègle générale, les antigènes sont des macromolécules, mais toute macromolécule n'est pas obligatoirement immunogène. L'immunogénicité d'une macromolécule est d'autant plus élevée que sa taille est plus importante. Exceptionnellement, un certain nombre de molécules de faible taille moléculaire... -
ÉLECTROPHORÈSE
- Écrit par Jean GUASTALLA , Jean MORETTI et Jean SALVINIEN
- 4 742 mots
- 10 médias
On a décrit plusieurs procédés qui permettent de séparer des groupes de protéines (albumine, α1, α2, β1, β2, γ-globulines) en vue depréparer ces fractions à partir, par exemple, d'un sérum. À cet effet, on utilise des portoirs de grandes dimensions dans lesquels on met une pâte d'amidon,... - Afficher les 11 références
Voir aussi
- ENZYMES
- HYDROPHOBE LIAISON
- DIALYSE À L'ÉQUILIBRE
- IMMUNOÉLECTROPHORÈSE
- FLUORESCENCE
- GÉLOSE ou AGAR-AGAR
- DIFFUSION
- COMPLÉMENT, immunologie
- ÉQUILIBRE, chimie
- PRÉCIPITATION, chimie
- THERMODYNAMIQUE CHIMIQUE
- ÉNERGIE DE LIAISON
- DOSAGE, biologie et médecine
- ENTHALPIE LIBRE ou ÉNERGIE LIBRE DE GIBBS
- ANTICORPS
- HAPTÈNE
- AGGLUTINATION, immunologie
- IMMUNOGLOBULINES
- IMMUN-SÉRUM ou ANTISÉRUM
- LIAISONS BIOCHIMIQUES FAIBLES
- RÉACTION IMMUNITAIRE
- ÉPITOPES ou DÉTERMINANTS ANTIGÉNIQUES
- CONSTANTE D'ÉQUILIBRE, chimie
- IMMUNOENZYMOLOGIE
- COMPLEXE IMMUN
- MARQUAGE, biotechnologie