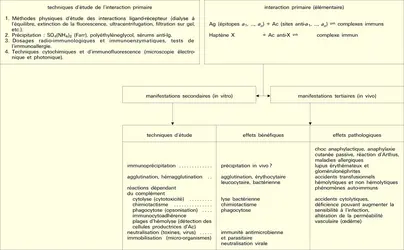
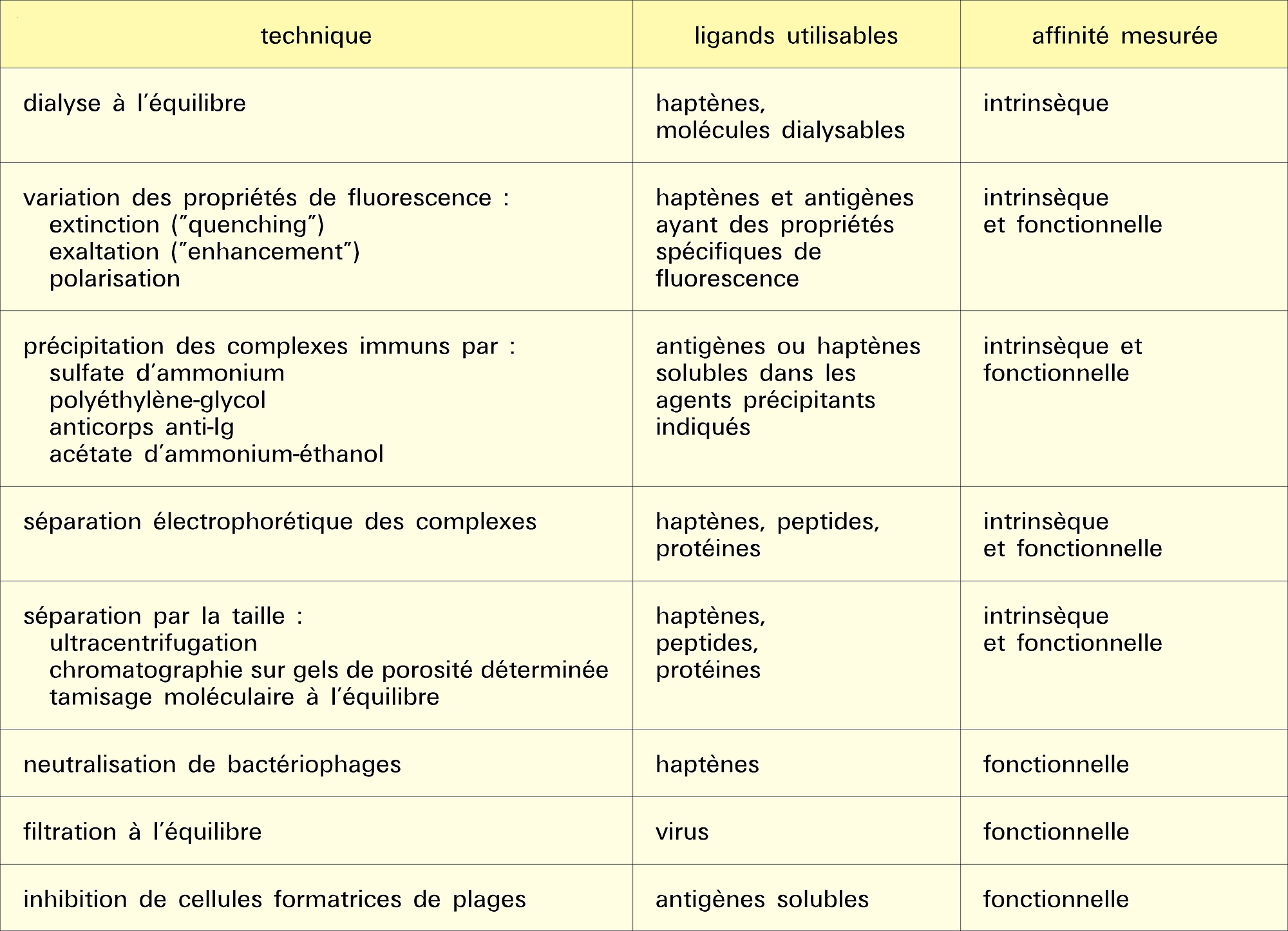
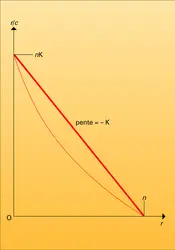
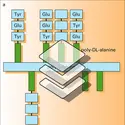
- 1. Paramètres de la réaction épitope (ou haptène)-site anticorps
- 2. Forces moléculaires de liaison impliquées dans la réaction antigène-anticorps
- 3. Affinité des anticorps
- 4. Réactions de précipitation (immunoprécipitation)
- 5. Immunoanalyse par les méthodes immunoenzymologiques
- 6. Réactions d'agglutination
- 7. Bibliographie
IMMUNOCHIMIE
Immunoanalyse par les méthodes immunoenzymologiques
Cette méthodologie d'immunodosages quantitatifs fondée sur l'interaction primaire Ag-Ac est, à l'heure actuelle, une des plus utilisées en immunoanalyse. Elle a été proposée pour la première fois en 1971 par trois équipes de recherche : en France par Avraméas et Guibert, aux Pays-Bas par Van Weeman et Schnurs et en Suède par Engvall et Perlmann qui l'ont décrite sous l'acronyme Elisa (pour Enzyme Linked Sorbent Assay) universellement utilisé depuis 1971.
Cette réaction immunologique est fondée sur une technique de marquage par une enzyme de l'un des éléments, l'antigène ou l'anticorps, qui intervient dans la réaction. L'utilisation d'enzymes comme marqueur présentait l'avantage considérable de conférer une grande sensibilité à la réaction Ag-Ac en raison de la propriété de l'enzyme liée à l'un des partenaires de la réaction (le plus souvent l'anticorps) de transformer un très grand nombre de molécules de substrat, c'est-à-dire à l'amplification du signal servant de révélateur de la réaction.
Les modalités de la réaction sont très variées. Elles permettent de doser soit l'antigène, soit l'anticorps. Elles peuvent s'effectuer en phase hétérogène ou homogène selon un processus de type compétitif ou non compétitif. Elles sont actuellement pratiquées le plus souvent dans les cupules de microplaques en matière plastique. On les exécute manuellement ou à l'aide de machines automatiques dotées d'un enregistrement sur bandes imprimantes. Pour être fiables, les réactions immunoenzymatiques nécessitent l'emploi de préparations d'antigènes et d'anticorps polyclonaux ou monoclonaux très spécifiques et soigneusement purifiés et contrôlés.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Joseph ALOUF : membre titulaire de l'Académie nationale de pharmacie, professeur honoraire à l'Institut Pasteur, Paris, directeur de recherche honoraire au C.N.R.S., professeur à l'Institut Pasteur de Lille
Classification
Médias
Autres références
-
ALLERGIE & HYPERSENSIBILITÉ
- Écrit par Bernard HALPERN , Georges HALPERN , Salah MECHERI et Jean-Pierre REVILLARD
- 12 574 mots
- 2 médias
Lesétudes immunologiques ont montré que la spécificité antigénique est souvent l'attribut d'une petite fraction de la molécule. Le développement de la chimiosynthèse au cours des dernières décennies a permis de jeter quelque lumière sur la nature du déterminant antigénique et de sa spécificité grâce... -
ANTICORPS MONOCLONAUX
- Écrit par Michel MAUGRAS et Jean-Luc TEILLAUD
- 2 137 mots
Les anticorps, ou immunoglobines, sont des protéines sécrétées par une famille de cellules, les lymphocytes, dont la principale propriété est de reconnaître le « non-soi ». Les substances chimiques reconnues comme étrangères, qu'elles soient des associations de molécules ou des molécules, sont...
-
ANTIGÈNES
- Écrit par Joseph ALOUF
- 7 382 mots
- 5 médias
Enrègle générale, les antigènes sont des macromolécules, mais toute macromolécule n'est pas obligatoirement immunogène. L'immunogénicité d'une macromolécule est d'autant plus élevée que sa taille est plus importante. Exceptionnellement, un certain nombre de molécules de faible taille moléculaire... -
ÉLECTROPHORÈSE
- Écrit par Jean GUASTALLA , Jean MORETTI et Jean SALVINIEN
- 4 740 mots
- 10 médias
On a décrit plusieurs procédés qui permettent de séparer des groupes de protéines (albumine, α1, α2, β1, β2, γ-globulines) en vue de préparer ces fractions à partir, par exemple, d'un sérum. À cet effet, on utilise des portoirs de grandes dimensions dans lesquels on met une pâte d'amidon,... - Afficher les 11 références