INTERFACES
Article modifié le
Une interface peut être définie, de la façon la plus générale, comme étant la zone qui sépare deux milieux A et B. Ces milieux doivent différer par au moins une des propriétés suivantes :
– composition chimique ;
– nature des phases : solides, variétés cristallines, liquides, gaz ;
– orientation cristalline (grains) ;
– ordonnancement (ordre-désordre) ;
– orientation du spin des électrons (domaines magnétiques).
En fait, l'usage est de parler de surface lorsqu'il s'agit de la limite entre un corps condensé (solide, liquide) et le vide ou éventuellement un gaz, et d'interface pour désigner la zone séparant deux milieux condensés.
À l'équilibre, le mouvement des atomes (ou leur changement d'état), de part et d'autre de l'interface n'est pas nul ; mais il se compense statistiquement, de sorte que l'interface est immobile à l'échelle de l'observation. Dans un système hors d'équilibre, les échanges ne se compensent plus et l'interface se déplace. Si les cinétiques sont suffisamment lentes, l'interface peut sembler immobile : le système est métastable. C'est le cas pratiquement de toutes les interfaces limitant les solides, à la température ambiante.
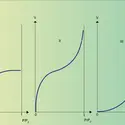
L'épaisseur réelle de la zone de transition est extrêmement faible : de un à quelques plans d'atomes, de sorte que l'interface peut être assimilée à une surface géométrique. Mais lorsqu'il y a variation de composition chimique, l'épaisseur de la zone perturbée, considérée comme interface, est généralement plus importante. L'interface continue cependant d'être assimilée à une surface tant que la méthode d'observation n'a pas une résolution latérale ou en profondeur supérieure à l'épaisseur réelle de l'interface. Examinée à une échelle plus fine, une interface peut soit disparaître, soit se résoudre en une succession d'interfaces élémentaires. Par exemple, la zone de diffusion entre deux métaux qui présentent une solution solide continue semble être une interface, quand l'échelle d'observation n'est pas suffisante. En revanche, si deux métaux forment un composé défini AB, le liseré du composé métallique AB apparaît comme une interface (macroscopique ou microscopique), alors qu'il est en réalité constitué de deux interfaces (microscopiques ou atomiques) A-AB et AB-B.
Une interface est conditionnée par les propriétés de chacun des deux milieux qu'elle sépare et elle est caractérisée par une énergie, dite interfaciale ou superficielle, qui dépend de la nature des liaisons atomiques au sein des deux milieux considérés. Les trois états de la matière (solide, liquide, gazeux) sont caractérisés par des types d'interaction entre atomes (ou molécules) très différents. À l'état solide, les atomes sont fortement liés entre eux, ce qui entraîne la rigidité du matériau et une forte énergie superficielle. Dans un liquide, la mobilité des atomes est plus grande, ce qui lui permet de conserver son volume mais non sa forme extérieure, et l'énergie superficielle est plus faible ; pour un gaz, les interactions sont négligeables et cette énergie est nulle.
Énergies superficielles et interfaciales
Définition thermodynamique
La définition thermodynamique de l'interface a été souvent sujette à controverses. J. W. Gibbs l'a considérée comme une surface de division sans épaisseur, une surface mathématique, alors que J. D. Van der Walls et H. Bakker lui ont attribué une épaisseur faible mais finie. E. A. Guggenheim a introduit le concept de « phase superficielle », traitant l'interface comme une phase plane séparant deux phases homogènes. Considérons par exemple deux phases, un liquide et un gaz, et mettons-les en contact. On peut décrire le système comme étant la somme de trois régions : un liquide[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Simone BOUQUET : docteur ès sciences, maître de conférences à l'université de Paris-VI-Pierre-et-Marie-Curie
- Jean-Paul LANGERON : directeur de recherche au C.N.R.S., ingénieur, École nationale supérieure de chimie de Paris
Classification
Médias
Autres références
-
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
L'adsorption est le phénomène qui consiste en l'accumulation d'une substance à l'interface entre deux phases (gaz-solide, gaz-liquide, liquide-solide, liquide-liquide, solide-solide). Il a son origine dans les forces d'attraction intermoléculaires, de nature et d'intensité variées, qui sont responsables...
-
CHIMIE - Histoire
- Écrit par Élisabeth GORDON , Jacques GUILLERME et Raymond MAUREL
- 11 189 mots
- 7 médias
Elle concerne toutes les réactions et plus généralement tous les phénomènes qui s'effectuent à l'interface de deux milieux : liquide-solide, solide-solide, solide-gaz. Elle joue un très grand rôle en biologie ainsi que dans de nombreux domaines de la chimie (catalyse hétérogène, électrochimie... -
COLLAGE, physique
- Écrit par Jacques COGNARD
- 6 456 mots
- 2 médias
Ilest clair que, pour réaliser un assemblage, il faut qu'il y ait une continuité entre les liaisons chimiques qui assurent la cohésion des substrats et la colle (ou l'adhésif). L' origine de cette liaison a été attribuée à des liaisons chimiques faibles, dites « de Van der Waals », ou « dispersives... -
COLLOÏDES
- Écrit par Didier ROUX
- 6 011 mots
...légèrement bleutée, peu visqueuse, et ne se différencie que très peu d'une solution aqueuse vraie. On peut cependant mesurer un changement de comportement de l'interface air-solution aqueuse lors de la formation de micelles. En effet, la tension superficielle entre l'air et le mélange baisse typiquement de... - Afficher les 13 références
Voir aussi
- MATÉRIAUX SCIENCE DES
- COLLAGE, technologie
- PRESSION, physique
- RECUIT
- LIQUIDE ÉTAT
- FORCE, physique
- ADOUCISSEMENT DE L'EAU
- JURIN LOI DE
- LAPLACE LOIS DE
- CATALYSEURS
- CHIMISORPTION
- FLOTTATION
- COMPOSITES À FIBRES MATÉRIAUX
- MOUILLANTS
- OXYDATION
- DÉFORMATIONS, mécanique
- SAVONS
- SOLIDIFICATION
- TENSION SUPERFICIELLE
- TENSIOACTIVES SUBSTANCES
- AMPHIPHILE MOLÉCULE
- DÉSORPTION
- CROISSANCE DES CRISTAUX
- CRISTALLISATION
- ÉVAPORATION, physique
- GAZEUX ÉTAT
- MISCIBILITÉ
- TEMPÉRATURE
- SOLIDES PHYSIQUE DES
- ÉNERGIE DE LIAISON
- SÉGRÉGATION, métallurgie
- IMPURETÉS, physique
- ALLOTROPIE
- ÉMULSION, chimie
- SOLIDE ÉTAT
- PHYSISORPTION
- ÉNERGIE SUPERFICIELLE
- JOINT DE GRAINS
- GRAIN, cristallographie
- YOUNG LOI DE
- BULLE, physique