INTERFACES
Article modifié le
Les différents types d'interfaces
Rappelons qu'il n'y a pas d'interface lorsque les atomes ou les molécules ont tendance à se mélanger ; c'est toujours le cas des gaz. Cependant, lorsque les gaz ont des densités très différentes, la décantation peut entraîner à forte échelle l'apparition d'une limite, mais il ne s'agit pas là d'une véritable interface puisque la composition varie de façon continue.
Interface corps condensé-gaz
Les échanges possibles entre un solide ou un liquide et un gaz sont la sublimation, l'évaporation et la condensation. La sublimation d'un solide ou l'évaporation d'un liquide donnent naissance à une phase gazeuse dont la pression à l'équilibre est appelée pression de vapeur saturante. Cet équilibre correspond, en fait, à un échange incessant de molécules entre chaque phase : il y a autant de molécules qui passent en phase gazeuse que de molécules qui se condensent. Leur nombre par unité de temps et de surface (n) est égal au nombre de chocs de molécules gazeuses à l'interface ; il se calcule par la théorie cinétique des gaz d'après la formule :
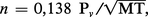
Lorsque la phase gazeuse et la phase condensée sont de nature différente, il peut y avoir adsorption en surface, éventuellement suivie d'une dissolution en volume dont la cinétique est contrôlée par la vitesse de diffusion. À l'équilibre, la concentration du gaz en solution dans un liquide est, aux faibles teneurs, proportionnelle à la pression (loi de Henry). Dans le cas des solides, l'équilibre est régi par la dissociation des molécules en surface lors de l'adsorption : la solubilité d'un gaz diatomique est proportionnelle à la racine carrée de la pression (loi de Sievert).
Le principe de minimisation de l'énergie impose une surface lisse et de courbure régulière dès qu'il y a mobilité suffisante des atomes : c'est le cas des liquides. Cela ne se produit dans les solides que si la température est suffisamment élevée ; le lissage de surface peut être obtenu par recuit à une température proche du point de fusion. Cependant, dans les solides cristallins, l'anisotropie d'énergie superficielle peut induire une rugosité d'équilibre due au développement de faces cristallines (striation, croissance des cristaux).
À l'échelle atomique, une surface quelconque se résout en faces simples avec formation de « marches » et de « crans ». L'énergie superficielle n'est alors qu'une valeur moyenne, l'énergie propre de chaque atome croissant avec le nombre de liaisons rompues. Cela explique pourquoi l'interaction gaz-solide est beaucoup plus importante que l'interaction gaz-liquide, surtout lorsque le solide est rugueux et divisé (adsorption, catalyse). Deux autres modes de minimisation de l'énergie superficielle sont la relaxation et la reconstruction de surface. Dans la relaxation, seul le paramètre réticulaire perpendiculaire à l'interface est modifié.
Le phénomène de reconstruction correspond à un changement dans l'arrangement des atomes de surface. Il a lieu principalement dans les semi-conducteurs (Si), où l'existence de liaisons chimiques différentes ou insaturées peut créer des champs électriques susceptibles d'être ressentis jusqu'à 1 μm de profondeur, alors que cette distance ne dépasse pas 1 nm dans les métaux.
Adsorption
Lorsqu'une molécule de gaz frappe une surface, elle peut s'y fixer[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Simone BOUQUET : docteur ès sciences, maître de conférences à l'université de Paris-VI-Pierre-et-Marie-Curie
- Jean-Paul LANGERON : directeur de recherche au C.N.R.S., ingénieur, École nationale supérieure de chimie de Paris
Classification
Médias
Autres références
-
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
L'adsorption est le phénomène qui consiste en l'accumulation d'une substance à l'interface entre deux phases (gaz-solide, gaz-liquide, liquide-solide, liquide-liquide, solide-solide). Il a son origine dans les forces d'attraction intermoléculaires, de nature et d'intensité variées, qui sont responsables...
-
CHIMIE - Histoire
- Écrit par Élisabeth GORDON , Jacques GUILLERME et Raymond MAUREL
- 11 189 mots
- 7 médias
Elle concerne toutes les réactions et plus généralement tous les phénomènes qui s'effectuent à l'interface de deux milieux : liquide-solide, solide-solide, solide-gaz. Elle joue un très grand rôle en biologie ainsi que dans de nombreux domaines de la chimie (catalyse hétérogène, électrochimie... -
COLLAGE, physique
- Écrit par Jacques COGNARD
- 6 456 mots
- 2 médias
Ilest clair que, pour réaliser un assemblage, il faut qu'il y ait une continuité entre les liaisons chimiques qui assurent la cohésion des substrats et la colle (ou l'adhésif). L' origine de cette liaison a été attribuée à des liaisons chimiques faibles, dites « de Van der Waals », ou « dispersives... -
COLLOÏDES
- Écrit par Didier ROUX
- 6 011 mots
...légèrement bleutée, peu visqueuse, et ne se différencie que très peu d'une solution aqueuse vraie. On peut cependant mesurer un changement de comportement de l'interface air-solution aqueuse lors de la formation de micelles. En effet, la tension superficielle entre l'air et le mélange baisse typiquement de... - Afficher les 13 références
Voir aussi
- MATÉRIAUX SCIENCE DES
- COLLAGE, technologie
- PRESSION, physique
- RECUIT
- LIQUIDE ÉTAT
- FORCE, physique
- ADOUCISSEMENT DE L'EAU
- JURIN LOI DE
- LAPLACE LOIS DE
- CATALYSEURS
- CHIMISORPTION
- FLOTTATION
- COMPOSITES À FIBRES MATÉRIAUX
- MOUILLANTS
- OXYDATION
- DÉFORMATIONS, mécanique
- SAVONS
- SOLIDIFICATION
- TENSION SUPERFICIELLE
- TENSIOACTIVES SUBSTANCES
- AMPHIPHILE MOLÉCULE
- DÉSORPTION
- CROISSANCE DES CRISTAUX
- CRISTALLISATION
- ÉVAPORATION, physique
- GAZEUX ÉTAT
- MISCIBILITÉ
- TEMPÉRATURE
- SOLIDES PHYSIQUE DES
- ÉNERGIE DE LIAISON
- SÉGRÉGATION, métallurgie
- IMPURETÉS, physique
- ALLOTROPIE
- ÉMULSION, chimie
- SOLIDE ÉTAT
- PHYSISORPTION
- ÉNERGIE SUPERFICIELLE
- JOINT DE GRAINS
- GRAIN, cristallographie
- YOUNG LOI DE
- BULLE, physique