IODE
Propriétés chimiques
L'iode à l'état élémentaire I2 (diiode) se prépare en oxydant des iodures I– par le chlore ou le dioxyde de manganèse en milieu acide : 2 I– + Cl2 → I2 + 2 Cl–, 2_I– + 4H+ + MnO2 → I2 + 2H2O + Mn++.
Des réducteurs comme l'hydrogène sulfuré H2S ou l'hydrazine H2N-NH2 font passer le diiode de l'état d'oxydation 0 à l'état –1, celui des anions iodure I– : I2 + H2S → 2 HI + S (soufre précipitant), 2 I2 + H4N2 → 4 HI + N2 (diazote gazeux).
L'acide nitrique oxyde le diiode à l'état d'oxydation +5, dénoté I(V), celui des anions iodate IO3– : I2 + 10 HNO3 → 2 HIO3 + 10 NO2 + 4 H2O.
Il en va de même pour l'oxydation par les chlorates : I2 + 2 ClO3– → 2 IO3– + Cl2.
En solution aqueuse, les bases convertissent le diiode I2 en anions iodure et iodate, à la suite du processus en deux étapes : I2 + 2 OH– → I– + IO– + H2O (K = 30), 3 IO– → 2 I– + IO3– (K = 1 020).
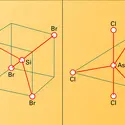
La chimie de l'iode est marquée par la tendance de cet élément à la multicoordination. L'atome d'iode forme des liaisons relativement faibles, mais pouvant être nombreuses (de 2 à 8) avec des atomes ou des groupements d'atomes fortement attracteurs des électrons. Ainsi, au nombre des composés interhalogènes, sont connues des molécules telles que IF3 ou ICl3, IF5, IF7. L'iode est dit polyvalent, multivalent ou hypervalent dans de tels composés. Les deux premiers adjectifs décrivent des composés de I(III) ou de I(V), voire de I(VII) lorsqu'il s'agit de composés purement minéraux.
Le terme « hypervalent », que Jeremy I. Musher introduisit en 1969, se réfère à des liaisons chimiques faibles, dans lesquelles deux électrons occupent un niveau d'énergie liant, tandis que deux autres électrons occupent un niveau d'énergie non liant, ce qui correspond, en quelque sorte, à une demi-liaison covalente.
L'iode I(III) se trouve lié à une chaîne carbonée R dans les bishaloiodanes RIX2, où X désigne un atome d'halogène. L'iode I(V) est souvent lié à des cycles carbonés aromatiques Ar dans des dérivés comme ArIF4, ArIO2 ou encore Ar2IF2+. Il peut s'agir aussi de [bis(acyloxy)iodo]arènes de formule générale ArI(OOCR)2. Cela se décrit de façon systématique par les formules IL5, IZL3 et IZ2L, où L désigne un coordinat univalent et Z un coordinat divalent.
La force du raisonnement chimique par analogie est patente au vu des composés de l'iode dérivant du modèle des iodates IO3–. On connaît en effet de nombreux composés de formule ILn–, où n est un entier pair (n = 2, 4, 6, 8) et L un atome ou un groupement d'atomes. Les anions iodures I– s'insèrent en effet dans les liaisons X-Y pour former des composés (X-I-Y)-. Tel est le cas de la molécule de diiode I2 elle-même : I– + I2 → I3– (triiodure) ; I3– + I2→I5– (pentaiodure) ; I5– + I2→I7– (heptaiodure) ; et ainsi de suite (polyiodures). Lorsqu'en effet un anion L– s'insère dans une liaison L-I, on forme des dérivés anioniques de type (L-I-L)–. Mais il peut s'agir aussi d'un hétéroatome L porteur d'une paire d'électrons non liants L :, auquel cas l'attaque de L-I conduit à des composés L+-I–-L dits zwitterioniques ; et celle de L+-I à des composés cationiques de formule L+-I–-L+. En particulier, le cryptand (cf. chimie supramoléculaire) de Jean-Marie Lehn, lorsqu'on le met en présence de diiode, encapsule un anion iodure, tandis qu'un autre anion iodure externe satisfait au maintien de l'électroneutralité.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre LASZLO : professeur honoraire à l'École polytechnique et à l'université de Liège (Belgique)
Classification
Médias
Autres références
-
ALIMENTATION (Économie et politique alimentaires) - Malnutrition dans le monde
- Écrit par Laurence ROUDART
- 7 611 mots
- 9 médias
La carence en iode est également très répandue. À partir de certains seuils et selon les sujets, cette insuffisance cause la formation d'un goitre thyroïdien, une arriération mentale et des cas de surdité-mutité chez les nouveau-nés. -
ANTISEPSIE ET ASEPSIE
- Écrit par Gabriel GACHELIN
- 587 mots
- 1 média
Classiquement, l’histoire de la chirurgie est scandée par deux dates : l’année 1846, au cours de laquelle l’anesthésie à l’éther est utilisée pour la première fois ; l’année 1867, au cours de laquelle le chirurgien britannique Joseph Lister (1827-1912) décrit le succès d’une...
-
CATALYSE
- Écrit par Henri Jean-Marie DOU et Jean-Eugène GERMAIN
- 8 394 mots
- 7 médias
Ainsi, vers 600 0C, la vapeur d'iode s'empare de l'hydrogène des alcanes pour former de l'acide iodhydrique et des alcènes ou des hydrocarbures dérivés du benzène, de rapport H/C plus faible. D'autre part, l'oxygène attaque l'acide iodhydrique en lui arrachant son hydrogène, pour... -
HALOGÈNES
- Écrit par Jacques METZGER et Robert de PAPE
- 6 600 mots
- 5 médias
Les dérivés halogénés résultent du remplacement, par des halogènes F, Cl, Br, I, d'un ou de plusieurs atomes d'hydrogène des hydrocarbures. Ils se rencontrent rarement à l'état naturel : présence d'iode dans la tyroxine, présence de chlore dans l'antibiotique chloromycétine.... - Afficher les 12 références