IRRÉVERSIBILITÉ
Évaluation de la production d'entropie
Un grand progrès fut réalisé lorsque l'on réussit à évaluer explicitement la production d'entropie : on disposa dès lors d'une mesure quantitative des phénomènes irréversibles. Les grands noms liés à ces développements sont ceux de T. de Donder, L. Onsager, I. Prigogine.
Le point de départ de l'évaluation de la production d'entropie est une formule, due à J. W. Gibbs, qui relie la variation d'entropie dS à la variation d'énergie interne, à la variation de volume et aux vitesses des réactions chimiques qui se produisent dans le système. L'étape la plus importante consiste à combiner cette formule thermodynamique avec les lois d'évolution données par d'autres disciplines de la physique macroscopique : hydrodynamique, électrodynamique, cinétique chimique, etc. Ces lois fournissent des expressions explicites pour la variation d'énergie et pour les vitesses réactionnelles. Après quelques transformations simples, on arrive à écrire la variation de l'entropie sous la forme :
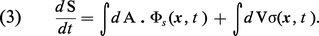
Le premier terme est l'intégrale, prise sur la surface du système, du vecteur flux d'entropie. Le deuxième terme, une intégrale de volume, représente la production d'entropie à l'intérieur du système. Cette équation correspond, terme à terme, à la relation (1), en donnant, de plus, des expressions explicites des grandeurs qui y figurent. Un examen de ces dernières montre que la production locale d'entropie a une forme très remarquable :

La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Radu BALESCU : professeur à l'université de Bruxelles
Classification
Autres références
-
AFFINITÉ CHIMIQUE
- Écrit par Paul GLANSDORFF
- 1 166 mots
La notion d'affinité chimique est relativement ancienne. On la rencontre déjà, bien que sous un aspect encore purement qualitatif, dans les spéculations des alchimistes sur la transmutation des métaux au Moyen Âge (Albert le Grand, 1193-1280). Quant au terme lui-même, il semble avoir été...
-
HASARD & NÉCESSITÉ
- Écrit par Encyclopædia Universalis , Ilya PRIGOGINE et Isabelle STENGERS
- 9 616 mots
...lutte de Boltzmann, qui tenta en vain de séparer déterminisme dynamique et réversibilité (I. Prigogine et I. Stengers, 1988), c'est-à-dire de montrer que l'évolution irréversible, à entropie croissante, vers l' équilibre thermodynamique si elle n'avait pas de sens en ce qui concerne une particule individuelle,... -
ISOTROPIE & ANISOTROPIE
- Écrit par Viorel SERGIESCO
- 738 mots
Au sens général du terme, une grandeur physique (macroscopique ou microscopique) est anisotrope, ou isotrope, selon qu'elle dépend ou non de la direction suivant laquelle on la mesure. Ainsi, la densité d'un corps homogène ou la fonction de distribution des vitesses à l'équilibre thermodynamique...
-
ONSAGER LARS (1903-1976)
- Écrit par Paul GLANSDORFF
- 588 mots
Chimiste et physicien américain né à Oslo de parents norvégiens. Dès 1925, Lars Onsager obtient dans cette ville son diplôme d'ingénieur chimiste à l'École technique supérieure de Norvège.
Au cours de ses études, Lars Onsager manifeste déjà des dispositions particulières pour...
- Afficher les 17 références

