ROSE IRWIN (1926-2015)
Article modifié le
Le biochimiste américain Irwin Rose a partagé le prix Nobel de chimie en 2004 avec les Israéliens Aaron Ciechanover et Avram Hershko pour leur découverte conjointe du procédé par lequel les cellules de la plupart des organismes vivants éliminent les protéines défectueuses ou trop vieilles.
Né le 16 juillet 1926 à Brooklyn (New York), Irwin Allan Rose obtient un diplôme (Ph.D) de biochimie à l’université de Chicago en 1952. Il travaille de 1954 à 1963 à la faculté de l’École de médecine de l’université Yale, avant de devenir senior member de 1963 à 1995 au Fox Chase Cancer Center de Philadelphie. En 1997, il accepte une nomination spéciale de chercheur émérite à l’université de Californie, à Irvine.
Avant ses travaux sur la dégradation des protéines, Irwin Rose a une carrière d’enzymologiste et s’intéresse particulièrement, au cours des années 1950, au métabolisme des sucres dans les cellules, avec Severo Ochoa et Marianne Grunberg-Manago. Il s’attache aussi à comprendre le rôle du magnésium dans les activités enzymatiques.
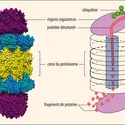
À la fin des années 1970 et au début des années 1980, Irwin Rose, Aaron Ciechanover et Avram Hershko travaillent ensemble au Fox Chase. Les trois scientifiques comprennent que l’ubiquitine (une petite protéine de 76 acides aminés, ainsi nommée parce qu’on la retrouve dans toutes les cellules de tous les organismes) s’attache à une protéine « indésirable » pour la vie cellulaire (mal formée, vieillie, etc.) et la transporte jusqu’à un protéasome, une sorte de bloc d’enzymes, qui dégrade la protéine en acides aminés ou en peptides, et auquel seules les protéines couplées à une molécule d’ubiquitine peuvent accéder. Ainsi, alors que la destruction des protéines est un phénomène vital, l’ubiquitinylation est une sorte de marquage vers ce phénomène, réalisé par l’action d’une cascade de trois enzymes. La découverte de l’ubiquitine et des protéasomes par ces chercheurs est faite entre 1978 et 1980.
Rose et ses collègues démontrent ensuite que la dégradation des protéines induite par l’ubiquitinylation aide à contrôler un grand nombre de processus biochimiques cruciaux, tels que la division cellulaire, la réparation des défauts de l’ADN et la transcription des gènes, c’est-à-dire la synthèse des protéines pour lesquelles ces gènes codent, mais aussi le montage de réponses immunitaires spécifiques d’un antigène. Des maladies comme certaines formes de mucoviscidose, de nombreux types de cancers et de maladies auto-immunes et neurodégénératives peuvent survenir quand la dégradation des protéines ne se fait plus normalement. Les découvertes de l’équipe conduisent au développement d’un médicament, le bortézomib (inhibiteur du protéasome), utilisé dans le traitement du myélome multiple (un cancer du sang).
Irwin Rose meurt le 2 juin 2015 à Deerfield (Massachusetts).
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Encyclopædia Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Autres références
-
GNF6702, INHIBITEUR DE PROTÉASOMES
- Écrit par Gabriel GACHELIN
- 1 995 mots
- 4 médias
...découverte du rôle conjoint de l’ubiquitine et des protéasomes a été récompensée par le prix Nobel de chimie, en 2004, décerné à A. Ciechanover, A. Hershko et I. Rose. À l’inverse, quand l’activité enzymatique des protéasomes est inhibée, les protéines marquées, « ubiquitinylées », s’accumulent dans la cellule,...
Voir aussi