ISOMÉRIE, chimie
Article modifié le
Résonance ou mésomérie
Il revint à Linus Carl Pauling de faire la synthèse de ces trois composantes conceptuelles : nécessité des deux formules de Kekulé du benzène ; formules de Lewis pour l'écriture des molécules ; notion d'intégrale d'échange, dans le formalisme de la mécanique quantique, pour rendre compte de l'indiscernabilité, et donc de la délocalisation des électrons au sein de n'importe quelle molécule. Son apport, outre cette synthèse, fut la notion de résonance : les molécules de la chimie, comme des cordes vibrantes, ou des oscillateurs quelconques, peuvent entrer en résonance.
Une molécule quelconque, dans cette description due à Pauling, et que l'on qualifie aussi de mésomérie, existe simultanément sous divers visages, ou formes-limites. Ainsi, les formules de Kekulé sont deux des formes-limites (il en existe d'autres) pour la molécule de benzène. Aucune de ces formules (de Lewis) n'offre à elle seule une représentation entièrement satisfaisante de la réalité. Seul l'ensemble de ces formes-limites, avec leurs résonances associées, donne une représentation convenable.
Cela est suffisamment important pour insister : une formule unique, en règle générale, ne suffit pas à représenter correctement une molécule. La raison en est que les tirets, qui conventionnellement figurent les liaisons, localisent les électrons entre les paires d'atomes dont se constitue la molécule ; alors que l'ensemble des électrons sont en fait délocalisés sur l'ensemble de la molécule. La résonance ou mésomérie, qu'imagina Linus Pauling, est un artifice permettant de sauvegarder les formules de Lewis. Celles-ci, en effet, par leur simplicité, représentent un outil précieux. Les conserver, tout en relativisant leur contenu informationnel, fut un habile tour de passe-passe.
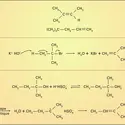
La molécule de monoxyde de carbone CO est un bon exemple de raisonnements guidés par le formalisme de la mésomérie. La forme-limite avec une liaison double entre les atomes a pour elle l'absence de toute séparation de charges électriques, de signes opposés, qui coûterait de l'énergie. La forme-limite avec une liaison triple entre les deux atomes, C et O, a pour elle, a priori, sa force plus grande ; mais elle souffre d'imposer une telle séparation des charges qui, de plus, met la charge positive sur un atome a priori rebelle, celui d'oxygène. Conclusion ? CO se représente au moyen de la coexistence de ces deux formes-limites, en résonance.
La théorie de la résonance qu'énonça Pauling spécifiait que, pour contribuer à l'hybride de résonance, les diverses formes-limites ne doivent différer ni quant à l'emplacement des noyaux des atomes, ni quant à leurs nombres d'électrons célibataires. De plus, leurs énergies estimées doivent rester comparables. George Willard Wheland (1907-1974) résuma parfaitement ces principes : un hybride de résonance représente une entité bien réelle, tandis que les formes-limites servent à expliquer « une réalité inhabituelle par référence à des fictions familières ».
La notion de résonance eut un impact important sur le concept de liaison chimique. Elle incita d'emblée, dès les années 1930-1940, à une radicale remise en cause du modèle de Lewis, celui de la liaison chimique assurée par une paire d'électrons. Elle généralisa ce modèle à des liaisons à un ou à trois électrons. Un autre mérite de la notion de résonance fut son hypothèse implicite de l'indépendance les unes par rapport aux autres des liaisons dans une molécule, ce qui sous-entendait l'additivité des énergies de liaison – un résultat qui eut son heure de gloire dans les années 1950 et 1960 surtout.
Un temps, la théorie de la résonance entra en concurrence avec sa contemporaine, la théorie des orbitales moléculaires. Cette dernière, portée par Charles A. Coulson et H. Christopher Longuet-Higgins l'emporta, à partir de la fin des années 1940.
Mais il y eut une retentissante controverse, les autorités marxistes-léninistes dénonçant la théorie de la résonance comme un travers idéaliste de la pensée bourgeoise. Elle violait en effet le principe qu'avait édicté, en 1861, le Russe Alexandre M. Butlerov d'une formule unique pour chaque molécule. Ce n'est que graduellement, après la mort de Staline, que les scientifiques soviétiques purent eux aussi mettre à profit ce puissant formalisme.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Pierre LASZLO : professeur honoraire à l'École polytechnique et à l'université de Liège (Belgique)
Classification
Média
Autres références
-
ALCANES
- Écrit par Jacques METZGER
- 3 616 mots
- 11 médias
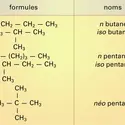
...quaternaires avec un atome primaire à l'extrémité de chacune des chaînes linéaires partielles, c'est alors un alcane ramifié présentant des nœuds iso ou néo. Les alcanes en C1, C2, C3 sont uniques mais, dès que la condensation en carbone est supérieure à 3, plusieurs formules développées correspondent à la... -
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 642 mots
- 4 médias
...la présence, dans son enchaînement carboné, de deux atomes de carbone adjacents, hybrides sp2, tricoordinés et qui échangent entre eux deux liaisons. Aux isoméries de structure qu'ils ont en commun avec les alcanes, les alcènes présentent deux autres modes d'isomérie : l'isomérie de position caractérisée... -
AMIDES
- Écrit par Jacques METZGER
- 1 922 mots
- 3 médias
Lesamides primaires et secondaires existent sous deux formes isomères en équilibre, l'espèce « imino-alcool » étant très peu abondante, sauf dans le cas des lactames (formule 10). Ce sont des molécules associées par liaison hydrogène, principalement à l'état de dimères (formule 11), mais également... -
BENZÉNOÏDES
- Écrit par Jacques METZGER
- 5 521 mots
- 6 médias
L'isomérie de position des dérivés disubstitués du benzène se traduit, dans leur nomenclature, par les préfixes ortho- (-1,2), méta- (-1,3) ou para- (-1,4) ; dans le cas du naphtalène, les substitutions en positions -1, -4, -5 ou -8 correspondent à la lettre α, en positions -2, -3, -6 ou -7... - Afficher les 20 références
Voir aussi