LIAISONS CHIMIQUES Liaison et classification
Article modifié le
Le problème de la nature de la liaison chimique s'est posé dès que fut entrevue la structure discontinue de la matière. Depuis l'Antiquité, chaque époque s'y est intéressée, proposant des solutions adaptées à ses connaissances. Démocrite munissait les particules de petits crochets afin de leur permettre de se lier entre elles. Le Moyen Âge, abandonnant une description aussi simpliste, introduisit la notion d'affinité, simple transposition des sentiments humains sans grand rapport avec la réalité.
Il fallut attendre la fin du xviiie siècle pour que soit tentée la première ébauche de théorie physique avec Laplace, qui essaya d'utiliser les lois de la gravitation récemment mises en évidence. La découverte de l'électrolyse (H. Davy, 1806) amena à identifier l'affinité entre les particules à une attraction entre charges électriques. J. J. Berzelius (1812) pensait que les atomes possédaient deux pôles électriques de signes opposés, expliquant ainsi la possibilité d'associations par interaction électrostatique. Cependant, à cette théorie s'opposa bientôt celle de J.-B. Dumas (1834), qui, au contraire, considérait que la molécule formait un tout, les atomes ayant perdu toute individualité dans celle-ci ; de là vint la notion de radicaux susceptibles de s'échanger au cours des réactions. La théorie de Dumas s'appliquait essentiellement aux composés organiques, non électrolysables, alors que celle de Berzelius, qui connut un regain de faveur à la suite des travaux de S. Arrhenius sur la dissociation des molécules en ions, paraissait mieux s'adapter aux composés minéraux. A. G. Werner (1892) découvrit la possibilité pour des ions de s'associer entre eux et de former de véritables molécules au sens de Dumas. De cet ensemble de faits assez confus résulta finalement l'idée de l'existence de plusieurs modes de liaisons totalement différents.
Lorsque la structure de l'atome fut élucidée, peu après 1900, le retour aux théories électriques s'imposait. Il était désormais hors de doute que les liaisons entre les atomes étaient assurées par l'intermédiaire des électrons (K. Starke, R. G. Parsons, 1915). W. Kossel (1916) développa une théorie fondée sur l'interaction électrostatique des ions dans les cristaux. Mais cette théorie se prêtait mal à une application aux molécules isolées, et en particulier lorsqu'elles étaient symétriques comme H2 ou Cl2.
Parallèlement, G. N. Lewis (1913) proposait un mode de liaison nouveau, la covalence, modèle perfectionné plus tard par I. Langmuir. Pour Lewis, la liaison était assurée par la mise en commun d'électrons entre les atomes avec formation de paires, le nombre de paires entourant les atomes étant limité à huit (règle de l'octet). Bien qu'assez proche de la réalité, cette ingénieuse théorie ne reposait sur aucun support théorique au moment où elle fut proposée. En conclusion, au début de ce siècle, la question de la nature de la liaison chimique restait entière. La multiplicité des explications proposées était la condamnation même de toutes ces interprétations, puisque la liaison chimique est en fait unique.
L'élaboration par Louis de Broglie, en 1924, de la mécanique ondulatoire éclaira d'un jour nouveau le problème. On savait désormais que la physique classique ne s'appliquait pas à l'infiniment petit, mais qu'il fallait faire appel à un autre formalisme. Le problème de l'atome d'hydrogène fut traité avec succès par E. Schrödinger dès 1926 et, aussitôt après, en 1927, W. Heitler et F. London, utilisant ces résultats, rendirent compte de la stabilité de la molécule H2. Ce mémoire fondamental ouvrit une voie nouvelle : la chimie théorique. Appuyée sur une base mathématique solide, la théorie de la liaison chimique n'a cessé depuis lors de se développer avec succès, si bien qu'aujourd'hui on peut considérer le problème comme résolu dans son principe, les seules difficultés étant d'ordre purement algébrique ou même simplement numérique.
Fondements de la théorie moderne
Principes de la mécanique quantique
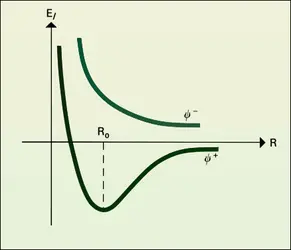
La description de l'état d'une particule, en mécanique quantique, se réduit à la seule connaissance d'une fonction Ψ des coordonnées et du temps, dite fonction d'onde. Cette fonction n'a pas de sens physique en elle-même, mais le carré de son module représente la probabilité de trouver à l'instant t les particules aux points de coordonnées correspondantes. Tout se passe comme si les particules avaient perdu leur individualité pour être remplacées par un nuage continu de densité |Ψ|2.
La fonction Ψ est solution d'une équation aux dérivées partielles, dite équation de Schrödinger. Dans le cas d'un système isolé, l'énergie reste constante et la fonction Ψ se décompose en un produit d'une fonction d'espace ψ, ne portant que sur les coordonnées des particules, et d'une fonction du temps, telle que la probabilité |ψ|2 reste constante au cours du temps et égale à |Ψ|2. On dit que le système est dans un état stationnaire. La fonction d'espace ψ est solution d'une équation plus simple qui s'écrit symboliquement : Hψ = Eψ, E désignant l'énergie du système et H un opérateur différentiel appelé hamiltonien. Schrödinger a formulé les règles de construction de cet opérateur.
L'étude mathématique des solutions de l'équation de Schrödinger montre que l'énergie ne peut pas prendre des valeurs arbitraires, ce qui se traduit par l'existence de niveaux énergétiques discrets. Les valeurs de l'énergie fournissant des solutions acceptables sont appelées valeurs propres de l'opérateur hamiltonien, et les fonctions d'onde correspondantes, fonctions propres. On démontre que ces fonctions sont orthogonales entre elles.
De plus, la théorie prévoit, en accord avec l'expérience, que, pour décrire complètement une particule, il faut lui adjoindre une coordonnée supplémentaire dite de spin. Cette dernière n'a pas d'équivalent classique, et il serait erroné d'essayer de chercher à lui donner une représentation élémentaire. Pratiquement, la fonction d'onde associée à une particule est le produit de la fonction d'espace, définie plus haut, par la fonction de spin. Cette dernière, comme la fonction d'espace, est fonction propre d'un certain opérateur. Pour un électron, cet opérateur ne possède que deux fonctions propres, notées en général α et β, et correspondant à des valeurs propres opposées.
Enfin, les fonctions électroniques sont antisymétriques par rapport à l'échange des électrons. Cette propriété a pour conséquence que deux électrons d'un système donné ne peuvent avoir toutes leurs caractéristiques identiques. Car, s'il en était ainsi, l'échange de ces deux électrons laisserait la fonction inaltérée (principe de Pauli).
Structures des atomes
On sait, depuis les expériences de E. Rutherford (1909), qu'un atome est constitué par des électrons de charge négative (− e) gravitant autour d'un noyau de charge positive, multiple de celle de l'électron (+ Ze) et de masse très supérieure, de sorte que, pratiquement, le problème se ramène au mouvement des seuls électrons autour de la charge nucléaire immobile.
L' intégration de l'équation de Schrödinger relative à l'atome le plus simple, celui de l'hydrogène ou des ions hydrogénoïdes (He2+, Li 3+, etc.), qui ne possèdent qu'un seul électron, est possible rigoureusement et fournit, pour les états stationnaires, des solutions qui se groupent, par familles d'énergie : − Z2/(2 n2) (où n est un entier positif), en unités atomiques :

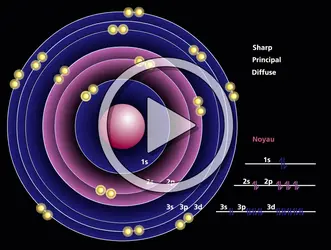
Pour n = 1, on a une fonction de symétrie sphérique, que l'on notera 1 s. Elle correspond à une densité électronique également sphérique. Pour n = 2, on a une fonction de symétrie sphérique 2s et trois fonctions, notées 2 p, de même nature entre elles et possédant chacune un axe de révolution. Les trois axes forment un trièdre trirectangle. On nommera ces fonctions : 2 px, 2 py et 2 pz, en indiquant l'axe en indice. Chaque fonction est antisymétrique par rapport au plan perpendiculaire à l'axe et passant par le noyau, ce qui entraîne que la densité est nulle dans ce plan et symétrique par rapport à ce plan hors de celui-ci.
Pour n = 3, on a une fonction de symétrie sphérique (3 s), trois fonctions de type p : (3 p), et cinq fonctions de structure plus complexe : 3 d.
D'une façon générale, on obtient, pour la famille d'énergie − Z2/(2 n2), n2 fonctions d'onde. Ces fonctions sont appelées orbitales atomiques. L'ensemble des orbitales correspondant à la même valeur de n forme une couche.
Le problème d'un atome quelconque contenant plusieurs électrons peut être envisagé comme une généralisation de celui de l'hydrogène. En effet, si on considère un électron donné, il est soumis à l'attraction du noyau et à la répulsion des autres électrons. En l'absence de champ électrique ou magnétique extérieur, aucune direction de l'espace n'est particularisée, si bien que le potentiel moyen auquel est soumis chaque électron est de symétrie sphérique. Tout se passe pour lui comme si la charge nucléaire centrale Z était diminuée à cause de l'effet d'écran causé par les autres électrons. Chaque électron peut donc être décrit par une fonction d'onde analogue aux orbitales atomiques de l'hydrogène, mais caractérisée par une charge nucléaire convenable. J. Slater a donné des règles simples pour calculer ces charges.
Une différence essentielle cependant est à noter. Alors que, dans l'atome d'hydrogène, les orbitales se groupent par familles de même énergie déterminée par le nombre n et comprenant n2 fonctions, ici les diverses orbitales d'une même couche se subdivisent en niveaux. Par ordre d'énergie croissante à l'intérieur d'une couche donnée, on trouve successivement (lorsqu'ils existent) le niveau s, les trois niveaux p confondus, les cinq niveaux d confondus, etc. Cet éclatement des composantes des diverses couches entraîne un enchevêtrement des niveaux relatifs à des couches différentes. Par exemple, on a la succession : 4 s < 3 d < 4 p, les différences d'énergie étant faibles.
Dans l'état de plus basse énergie, les électrons de l'atome tendent à se placer sur les niveaux les plus bas, à raison de deux au maximum par niveau. En effet, à une fonction d'espace donnée, on ne peut associer que deux fonctions de spin, correspondant à des valeurs propres opposées. On dit que les électrons forment des paires de spins antiparallèles. Nous laisserons de côté le cas d'un remplissage incomplet.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule. -
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
...nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques particulières. Du fait de ces interactions, des groupes R, éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés dans la structure spatiale et constituer, par exemple, le centre réactif... -
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...3- n'ont pu être caractérisés. L'ion Sb5+ n'existe pas, mais Sb3+ est connu, ce qui n'est pas le cas de son homologue arsénié. Comme dans le cas de l'arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales... - Afficher les 38 références
Voir aussi
- BUTADIÈNE
- ÉTHYLÈNE
- ÉLECTRONÉGATIVITÉ
- HYDROGÈNE LIAISON
- ORBITALES ATOMIQUES
- DÉLOCALISATION ÉLECTRONIQUE
- POLARISABILITÉ MOLÉCULAIRE
- INTERACTIONS MOLÉCULAIRES
- SCHRÖDINGER ÉQUATION DE
- POLAIRES MOLÉCULES
- MÉCANIQUE ONDULATOIRE
- ÉTHANE
- CRISTAL MACROMOLÉCULAIRE
- COVALENTE LIAISON
- SIMPLE LIAISON
- SIGMA ORBITALE
- PI ORBITALE
- SLATER JOHN CLARKE (1900-1976)
- PAIRES D'ÉLECTRONS MODÈLE DES, chimie
- ORBITALES MOLÉCULAIRES
- SLATER DÉTERMINANT DE
- TRIPLE LIAISON ou LIAISON ACÉTYLÉNIQUE
- HYBRIDATION DES ORBITALES
- HEITLER WALTER (1904-1981)
- ORBITALES LIANTES
- KEESOM INTERACTION DE
- FONCTION D'ONDE
- LCAO (linear combinations of atomic orbitals)
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- CONJUGUÉE LIAISON
- ORBITALES ANTILIANTES
- COUCHES ÉLECTRONIQUES
- INTRAMOLÉCULAIRES FORCES
- SOLIDIFICATION
- CRISTAL MOLÉCULAIRE
- QUANTIQUE MÉCANIQUE
- ÉNERGIE DE LIAISON
- NIVEAU, physique atomique
- OCTET RÈGLE DE L'
- DEBYE FORCES DE
- STABILITÉ, chimie
- LONDON FORCES DE
- CHIMIE HISTOIRE DE LA
- QUANTIQUE CHIMIE
- IONIQUE LIAISON
- FLUCTUATION, physique
- ÉTAT STATIONNAIRE
- RUTHERFORD ATOME DE
- DENSITÉ ÉLECTRONIQUE