LIAISONS CHIMIQUES Liaison et classification
Caractéristiques générales des liaisons
Deux cas sont à distinguer : les liaisons localisées et les liaisons délocalisées, c'est-à-dire conjuguées. Correspondant à un nuage électronique répandu sur toute la molécule, les liaisons conjuguées ont perdu leur individualité et le système doit être étudié dans son ensemble.
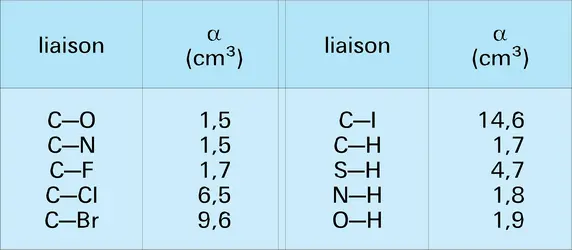
Les liaisons localisées sont pratiquement indépendantes du reste de la molécule, si bien qu'elles possèdent des caractéristiques à peu près constantes. Le tableau indique les valeurs des deux plus importantes : la longueur et l'énergie, pour quelques liaisons.
La constance des longueurs de liaison A − B dans les molécules permet de définir le rayon de liaison r des atomes par la relation : dAB = rA + rB.
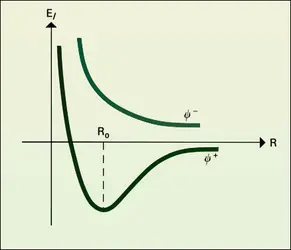
Si les atomes A et B liés ne sont pas de même nature, la densité électronique ne possède plus, comme pour H2, le plan médiateur du segment qui est formé par les noyaux comme plan de symétrie. Le nuage électronique est déplacé vers l'un des atomes, A par exemple ; on dit que A est plus électro-négatif que B. Mais il importe de préciser que jamais, dans une molécule, on n'aboutira à un déplacement total des électrons avec formation d'ions.
Le centre de gravité des électrons ne coïncidant alors plus avec celui des noyaux positifs, la liaison possède un moment dipolaire. Les moments des diverses liaisons se composent géométriquement pour donner le moment dipolaire total de la molécule.
Une autre caractéristique importante des liaisons est leur polarisabilité α, c'est-à-dire la facilité avec laquelle elles se déforment sous l'effet d'un champ électrique E extérieur, acquérant l'énergie supplémentaire : 1/2 αE2. Plus que la polarité liée au moment dipolaire permanent, la polarisabilité joue un rôle dans les problèmes de réactivité.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule. -
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
...nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques particulières. Du fait de ces interactions, des groupes R, éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés dans la structure spatiale et constituer, par exemple, le centre réactif... -
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...3- n'ont pu être caractérisés. L'ion Sb5+ n'existe pas, mais Sb3+ est connu, ce qui n'est pas le cas de son homologue arsénié. Comme dans le cas de l'arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales... - Afficher les 38 références