LIAISONS CHIMIQUES Liaison et classification
Article modifié le
Liaisons secondaires
À côté des forces assurant la cohésion des atomes à l'intérieur d'une molécule, on a coutume d'introduire des forces dites secondaires qui s'exercent soit entre les molécules, provoquant des associations plus ou moins stables, soit à l'intérieur même d'une molécule entre atomes non directement liés. En fait, ces forces n'ont pas une origine différente des forces de liaisons. L'intégration rigoureuse de l'équation de Schrödinger relative à l'ensemble de deux systèmes A et B étant impossible, dans la mesure où ces systèmes conservent leur individualité, l'énergie de l'ensemble apparaît comme la somme des énergies des systèmes isolés et d'une énergie que l'on qualifiera d'interaction. Mis en présence l'un de l'autre, les systèmes se déforment mutuellement, leurs fonctions d'onde ΨA et ΨB deviennent respectivement ΨA + ΔΨA et ΨB + ΔΨB. Si les modifications ΔΨ sont assez faibles, l'énergie d'interaction apparaîtra comme un développement limité en fonction des divers ordres de déformation. Le premier terme, correspondant aux parties principales ΨA et ΨB des nouvelles fonctions, pourra s'interpréter comme provenant de la simple interaction électrostatique entre les systèmes A et B indépendants. Les autres termes, correspondant à des déformations, seront qualifiés de termes de polarisation. Mais les diverses forces qui en résultent ne sont jamais que des combinaisons des forces de Coulomb entre les noyaux et les électrons, qui sont les seules forces introduites dans l'équation de Schrödinger.
On n'examinera ici que les types d'interaction les plus usuels.
Forces de Van der Waals
L'étude expérimentale des fluides met en évidence des forces responsables des écarts par rapport au fluide parfait à particules indépendantes. Ces forces expliquent, en particulier, le phénomène de liquéfaction.
À leur origine se trouve d'abord, si les molécules sont polaires, l'interaction dite de Keesom : l'énergie d'interaction entre deux molécules identiques de moment dipolaire μ est − 2/3 (μ4/kT)r-6 (k étant la constante de Boltzmann ; T, la température absolue) ; il en résulte des agrégats de molécules que détruira une élévation de température.
D'autre part, le champ créé par une molécule polaire provoque une déformation des molécules voisines (cf. supra, chap. 4) et l'on peut calculer classiquement l'énergie d'interaction qui en résulte, en introduisant la polarisabilité α des molécules. Cette énergie est proportionnelle à − αμ2r-6. Les forces qui en résultent sont dites de Debye. Un calcul quantique est cependant préférable.
Mais, à côté de ces forces qui apparaissent seulement entre molécules polaires, sont toujours présentes celles, dites de London, qui proviennent des termes de déformation, d'ordre supérieur. Pour des distances assez grandes, l'énergie correspondante varie encore à peu près proportionnellement à r-6.
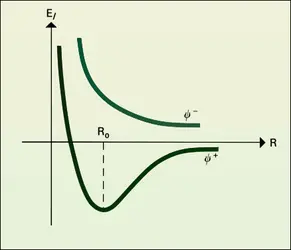
C'est l'ensemble de ces termes en r-6, correspondant par conséquent à une force attractive en r-7, qui porte le nom de forces de Van der Waals. Pour les très courtes distances, la force de London devient très grande et répulsive, ce qui se traduit pour les molécules et les atomes par l'existence d'un domaine d'impénétrabilité. Pratiquement, ce domaine, pour les atomes, est une sphère ; son rayon est le rayon d'impénétrabilité ou de Van der Waals. Il vaut, par exemple, 0,12 nm pour H, 0,15 nm pour N et 0,20 pour Br.
L'allure de la variation de l'énergie en fonction de la distance entre les deux systèmes est analogue à celle que l'on obtient pour la molécule H2. Dans la pratique, on utilise la forme suivante : ΔE = Ar-12 − Br-6. Une telle courbe[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule. -
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
...nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques particulières. Du fait de ces interactions, des groupes R, éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés dans la structure spatiale et constituer, par exemple, le centre réactif... -
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...3- n'ont pu être caractérisés. L'ion Sb5+ n'existe pas, mais Sb3+ est connu, ce qui n'est pas le cas de son homologue arsénié. Comme dans le cas de l'arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales... - Afficher les 38 références
Voir aussi
- BUTADIÈNE
- ÉTHYLÈNE
- ÉLECTRONÉGATIVITÉ
- HYDROGÈNE LIAISON
- ORBITALES ATOMIQUES
- DÉLOCALISATION ÉLECTRONIQUE
- POLARISABILITÉ MOLÉCULAIRE
- INTERACTIONS MOLÉCULAIRES
- SCHRÖDINGER ÉQUATION DE
- POLAIRES MOLÉCULES
- MÉCANIQUE ONDULATOIRE
- ÉTHANE
- CRISTAL MACROMOLÉCULAIRE
- COVALENTE LIAISON
- SIMPLE LIAISON
- SIGMA ORBITALE
- PI ORBITALE
- SLATER JOHN CLARKE (1900-1976)
- PAIRES D'ÉLECTRONS MODÈLE DES, chimie
- ORBITALES MOLÉCULAIRES
- SLATER DÉTERMINANT DE
- TRIPLE LIAISON ou LIAISON ACÉTYLÉNIQUE
- HYBRIDATION DES ORBITALES
- HEITLER WALTER (1904-1981)
- ORBITALES LIANTES
- KEESOM INTERACTION DE
- FONCTION D'ONDE
- LCAO (linear combinations of atomic orbitals)
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- CONJUGUÉE LIAISON
- ORBITALES ANTILIANTES
- COUCHES ÉLECTRONIQUES
- INTRAMOLÉCULAIRES FORCES
- SOLIDIFICATION
- CRISTAL MOLÉCULAIRE
- QUANTIQUE MÉCANIQUE
- ÉNERGIE DE LIAISON
- NIVEAU, physique atomique
- OCTET RÈGLE DE L'
- DEBYE FORCES DE
- STABILITÉ, chimie
- LONDON FORCES DE
- CHIMIE HISTOIRE DE LA
- QUANTIQUE CHIMIE
- IONIQUE LIAISON
- FLUCTUATION, physique
- ÉTAT STATIONNAIRE
- RUTHERFORD ATOME DE
- DENSITÉ ÉLECTRONIQUE