LIAISONS CHIMIQUES Liaison et classification
Article modifié le
L'état cristallin
Par abaissement de la température, les diverses particules constituant un gaz ou un liquide s'immobilisent, c'est la solidification. L'état ainsi obtenu est macroscopiquement caractérisé par sa rigidité. Deux cas se présentent : les particules se disposent ou bien au hasard formant un verre, ou bien dans un ordre déterminé, formant un cristal.
Malgré la diversité apparente des cristaux, il n'y a lieu de distinguer, du point de vue structural, que deux types : les cristaux moléculaires, dans lesquels on retrouve les éléments qui constituaient le liquide, isolés les uns des autres, et qui sont par conséquent formés de molécules de dimensions finies ; les cristaux macromoléculaires, formés d'enchaînements périodiques géants.
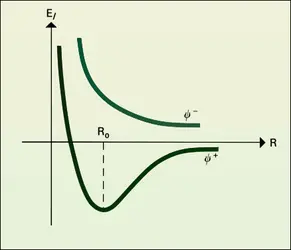
Dans les cristaux moléculaires, la cohésion entre les molécules est assurée par des forces de Van der Waals (benzène, anhydride carbonique, iode) ou par des liaisons hydrogène (glace). Ces cristaux sont facilement fusibles ou sublimables, et de faible dureté, à cause de la faiblesse des forces de cohésion.
Les cristaux macromoléculaires sont de trois catégories : les réseaux à trois dimensions, comme le diamant ou le chlorure de sodium, qui constituent des molécules géantes ; les réseaux à deux dimensions, qui forment des feuillets maintenus entre eux par des forces de Van der Waals ou des liaisons hydrogènes (micas, Cl2Cu) ; enfin, les réseaux linéaires, formés de fibres réunies par des forces de Van der Waals (tellure) ou des liaisons hydrogènes. Les énergies de liaison entre les divers atomes étant importantes (plusieurs dizaines de kilocalories par mole), les réseaux à trois dimensions sont caractérisés par leur rigidité et leur infusibilité. Dans les réseaux à deux dimensions, au contraire, les feuillets peuvent glisser les uns sur les autres, conférant au cristal un toucher onctueux (talc) et permettant un clivage facile (mica).
La structure des cristaux macromoléculaires est une simple généralisation de la structure moléculaire telle que nous l'avons exposée pour les petites molécules. On aura soit des liaisons localisées, plus ou moins polaires, établies entre atomes convenablement hybridés (diamant, rutile, fluorine), soit des liaisons complètement délocalisées comme dans les métaux. Mais, en aucun cas, il n'existera d'ions au sens strict. Tous les atomes, comme dans une molécule, sont liés les uns aux autres, sans solution de continuité. Par exemple, dans le rutile (TiO2), le titane est lié à six oxygènes (hybridation sp3d2), et l'oxygène à trois atomes (hybridation sp2) ; dans la fluorine, le calcium est lié à huit atomes de fluor, et le fluor à quatre calcium ; dans le chlorure de sodium, chaque atome est lié à six voisins.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule. -
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
...nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques particulières. Du fait de ces interactions, des groupes R, éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés dans la structure spatiale et constituer, par exemple, le centre réactif... -
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...3- n'ont pu être caractérisés. L'ion Sb5+ n'existe pas, mais Sb3+ est connu, ce qui n'est pas le cas de son homologue arsénié. Comme dans le cas de l'arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales... - Afficher les 38 références
Voir aussi
- BUTADIÈNE
- ÉTHYLÈNE
- ÉLECTRONÉGATIVITÉ
- HYDROGÈNE LIAISON
- ORBITALES ATOMIQUES
- DÉLOCALISATION ÉLECTRONIQUE
- POLARISABILITÉ MOLÉCULAIRE
- INTERACTIONS MOLÉCULAIRES
- SCHRÖDINGER ÉQUATION DE
- POLAIRES MOLÉCULES
- MÉCANIQUE ONDULATOIRE
- ÉTHANE
- CRISTAL MACROMOLÉCULAIRE
- COVALENTE LIAISON
- SIMPLE LIAISON
- SIGMA ORBITALE
- PI ORBITALE
- SLATER JOHN CLARKE (1900-1976)
- PAIRES D'ÉLECTRONS MODÈLE DES, chimie
- ORBITALES MOLÉCULAIRES
- SLATER DÉTERMINANT DE
- TRIPLE LIAISON ou LIAISON ACÉTYLÉNIQUE
- HYBRIDATION DES ORBITALES
- HEITLER WALTER (1904-1981)
- ORBITALES LIANTES
- KEESOM INTERACTION DE
- FONCTION D'ONDE
- LCAO (linear combinations of atomic orbitals)
- DOUBLE LIAISON ou LIAISON ÉTHYLÉNIQUE
- CONJUGUÉE LIAISON
- ORBITALES ANTILIANTES
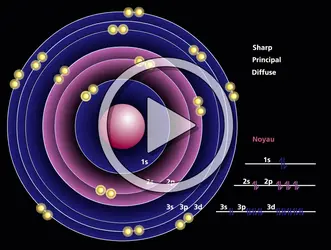
- COUCHES ÉLECTRONIQUES
- INTRAMOLÉCULAIRES FORCES
- SOLIDIFICATION
- CRISTAL MOLÉCULAIRE
- QUANTIQUE MÉCANIQUE
- ÉNERGIE DE LIAISON
- NIVEAU, physique atomique
- OCTET RÈGLE DE L'
- DEBYE FORCES DE
- STABILITÉ, chimie
- LONDON FORCES DE
- CHIMIE HISTOIRE DE LA
- QUANTIQUE CHIMIE
- IONIQUE LIAISON
- FLUCTUATION, physique
- ÉTAT STATIONNAIRE
- RUTHERFORD ATOME DE
- DENSITÉ ÉLECTRONIQUE