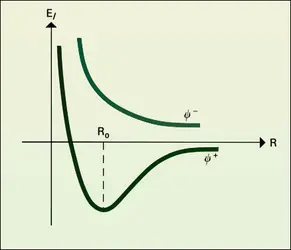
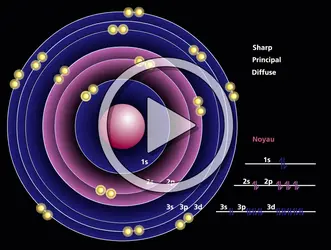
LIAISONS CHIMIQUES Liaison et classification
Bibliographie
Mémoires originaux
L. de Broglie, Recherches sur la Théorie des quanta, Masson, Paris, 1924, reprod. en fac-sim., Fondation Louis de Broglie, 1992
E. Hückel, « Zur Quantentheorie der Doppelbindung », ibid., vol. LX, p. 423, 1930
A. & P. Julg, « Vers une nouvelle interprétation de la liaison chimique », in Int. Journ. Quantum Chem., vol. XIII, p. 483, New York, 1978
J. Livage, « La Liaison chimique », in La Recherche, no 116, nov. 1980, pp. 1272-1283
L. Pauling & G. W. Wheland, « The Nature of the chemical bond. The quantum mechanical calculation of the resonance energy of benzene and naphtalene and the hydrocarbon free radicals », in Journ. Chem. Phys., vol. I, p. 362, Washington, 1933
E. Schrödinger, « Über das Verhaltnis der Heisenberg-Born-Jordanschen Quantenmechanik zu der meinen », in Ann. Phys., vol. LXXIX, pp. 361-478, 1926
J. C. Slater, Quantum Theory of Molecules and Solids, vol. I, III et IV, McGraw-Hill, 1963, 1969, 1974. Ouvrages généraux P. Arnaud, Cours de chimie physique, Dunod, Paris, 2e éd. 1991
C. A. Coulson, Coulson's Valence, Oxford Univ. Press, New York, 3e éd. 1980
H. Eyring, J. Walker & G. E. Kimball, Quantum Chemistry, J. Wiley, New York, 1944, rééd. 1960
A. Julg, Chimie quantique structurale et éléments de spectroscopie, O.P.U., Alger, 1978 ; La Liaison chimique, P.U.F., Paris, 1980 ; « Crystals as giant molecules », in Lecture Note in Chemistry, no 9, Springer Verlag, Berlin, 1980
J.-R. Lalanne dir., Structure électronique et liaison chimique, Masson, 1992
C. Meyer, Structure et liaison chimiques, Marketing, Paris, 1986
L. Pauling, The Nature of Chemical Bond, Cornell Univ. Press, New York, 3e éd., 1960
B. Vidal, Chimie quantique : de l'atome à la théorie de Hückel, Masson, Paris, 1992 ; La Liaison chimique : le concept et son histoire, J. Vrin, 1989
A. Zewail, The Chemical Bond : Structures and Dynamics, Academic Press, New York, 1992.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule. -
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
...nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques particulières. Du fait de ces interactions, des groupes R, éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés dans la structure spatiale et constituer, par exemple, le centre réactif... -
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...3- n'ont pu être caractérisés. L'ion Sb5+ n'existe pas, mais Sb3+ est connu, ce qui n'est pas le cas de son homologue arsénié. Comme dans le cas de l'arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales... - Afficher les 38 références