LIAISONS CHIMIQUES Liaison hydrogène
Caractéristiques générales des liaisons hydrogène
Peu de problèmes structuraux ont été autant étudiés que les liaisons hydrogène et pourtant il semble fort difficile, à partir de la masse des données expérimentales accumulées, de dégager les principales caractéristiques de ces liaisons, celles-ci variant d'une façon pratiquement continue sur de larges domaines.
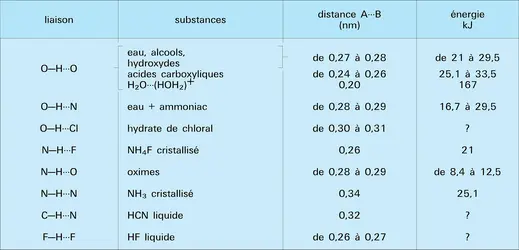
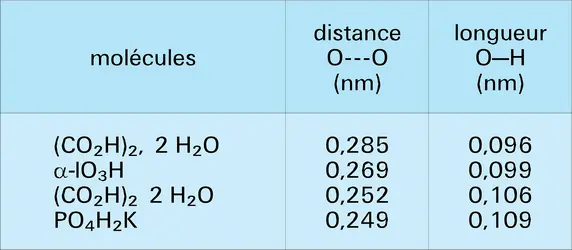
Par exemple, la distance entre les deux noyaux d'oxygène dans les associations O–H...O varie de 0,249 nm pour l'acide oxalique hydraté à 0,336 nm pour la chaux Ca(OH)2. En fait, la complexité n'est qu'apparente et n'est due qu'à la non-prise en considération de facteurs géométriques. Les caractéristiques de ces liaisons dépendent en effet essentiellement des possibilités de leur établissement. On devra distinguer les liaisons libres (celles dans lesquelles les molécules AH et B peuvent se lier sans qu'aucune gêne d'origine géométrique ou stérique ne vienne les empêcher de prendre leur disposition relative optimale) des liaisons contraintes, où des conditions géométriques viendraient, par exemple, imposer une torsion au système A–H...B, comme dans la plupart des liaisons intramoléculaires ou lorsque le groupement B est lié à plusieurs liaisons A–H, cas qui se présente dans certains cristaux. Pour dégager le caractère propre d'une liaison A–H...B de type donné, il faudra donc s'adresser à des exemples très particuliers pour lesquels le phénomène se rencontre à peu près exempt de perturbation.
On voit, d'après le tableau, que les énergies mises en jeu dans des associations entre édifices neutres sont nettement plus faibles que celles des liaisons normales. Par exemple, dans les associations O–H...O, l'énergie n'est que le vingtième environ de celle d'une liaison O–H. La petitesse de ces énergies explique l'influence de la température sur la solidité de l'association. En revanche, on remarquera l'énergie notable de la liaison entre une molécule d'eau et un ion OH+3, conférant une stabilité importante à l'édifice correspondant, justifiant ainsi le degré élevé d'hydratation des protons dans l'eau liquide.
Un autre fait à souligner est que la distance totale A---B est inférieure à la distance minimale d'approche des deux édifices AH et B, en l'absence de liaison. Par exemple, pour la liaison O–H...O, la distance minimale entre les noyaux d'oxygène serait la somme de la longueur de la liaison O–H (0,10 nm) et de celles des rayons de Van der Waals des atomes d'hydrogène et d'oxygène (0,10 + 0,12 nm), soit au total 0,32 nm. Il en résulte que la rupture des liaisons hydrogène éloignera les groupements AH et B, provoquant ainsi une augmentation du volume qui peut, dans le cas d'un cristal, provoquer son éclatement.
Il ressort d'autre part des longueurs totales rapportées sur le tableau que la distance totale A---B est d'autant plus courte que, pour une liaison A–H, l'électronégativité de B est plus élevée. Le cas des liaisons N–H...B est très net. L'existence de deux types de liaison O–H...O entre édifices neutres, longue ou courte, correspond à la différence de structure de la paire libre de l'atome d'oxygène jouant le rôle de B. C'est une paire décrite par une orbitale hydride sp3 dans le premier cas, sp2 dans le second.
On remarquera aussi que pour un type de liaison donné, O–H...O par exemple, l'énergie mise en jeu est d'autant plus forte que la distance totale est plus courte. Le tableau montre que, parallèlement, la longueur O–H est plus élevée, ce qui correspond à une perturbation plus importante.
Enfin, l'abaissement des fréquences de vibration du système A–H varie pratiquement linéairement avec la distance A---B, ce qui permet, pour un type de liaison donné, d'avoir[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule. -
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
...nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques particulières. Du fait de ces interactions, des groupes R, éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés dans la structure spatiale et constituer, par exemple, le centre réactif... -
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...3- n'ont pu être caractérisés. L'ion Sb5+ n'existe pas, mais Sb3+ est connu, ce qui n'est pas le cas de son homologue arsénié. Comme dans le cas de l'arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales... - Afficher les 38 références