LIAISONS CHIMIQUES Liaison hydrogène
Article modifié le
Étude théorique
La liaison hydrogène entre dans le cadre général des interactions intermoléculaires ou intramoléculaires. À strictement parler, c'est le système global A–H...B que l'on doit étudier directement comme un édifice moléculaire unique. Cependant, étant donné qu'à l'intérieur de celui-ci on peut, en général, encore reconnaître les constituants A–H et B, le problème de l'association est envisageable dans le cadre d'une théorie des perturbations.
Historiquement, les difficultés rencontrées dans le traitement direct de l'édifice global ont fait, jusqu'à ces dernières années, préférer le second point de vue. Dans cette optique, l'association des édifices A–H et B s'interprète par l'interaction électrostatique entre ceux-ci. La paire libre portée par le groupement B constitue un dipôle orienté du noyau vers H. Si la liaison A–H est polarisée dans le sens A- H+, elle sera attirée par le dipôle porté par B. De plus, sous l'effet du champ créé par la liaison A–H, le nuage électronique de la paire libre sera légèrement déformé, d'où l'apparition d'un moment induit qui viendra s'ajouter au moment initial et dont il faudra tenir compte dans le calcul de l'énergie d'interaction.
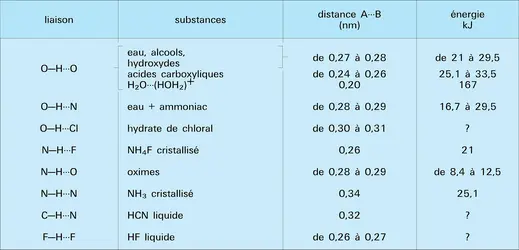
Ce schéma d'interprétation, bien qu'il soit approché, a l'avantage d'être très parlant du point de vue chimique. Il permet en particulier de comprendre l'origine d'un certain nombre de propriétés fondamentales des liaisons hydrogène. Il explique, par exemple, que seules les liaisons A–H de polarité A- H+ de sens constant, comme O–H ou N–H, donnent toujours des associations, alors que des liaisons comme C–H, qui, selon les cas, ont une polarité inverse, n'en donnent pas toujours.
Avec les hydrocarbures saturés, où, en général, l'hydrogène est négatif (C+H-), on n'aura pas d'associations, sauf si, sous l'effet induit par un atome fortement électronégatif comme le chlore, la polarité est renversée. C'est ce qui se produit dans le chloroforme Cl3CH qui donne des associations avec l'acétone. De même, une liaison sera possible avec l'acétylène ou l'acide cyanhydrique à cause de la charge nette positive de l'hydrogène. Ainsi s'explique la solubilité de l'acétylène dans l'acétone. La faible polarité des liaisons S–H et encore plus celle des liaisons Se–H et Te–H expliquent que les molécules SH2, SeH2 et TeH2 ne sont pas associées à l'état liquide.
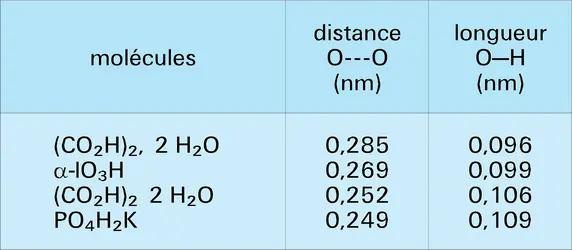
Le modèle électrostatique justifie aussi la corrélation qui existe, d'une part, entre la distance totale A---B et, d'autre part, l'énergie d'association, ainsi que l'allongement de la liaison A–H. En effet, plus les dipôles sont rapprochés, plus l'interaction et, par suite, la perturbation seront fortes.
Enfin, ce modèle explique que le maximum de stabilité, qui correspond à l'alignement des dipôles, exige que la liaison hydrogène soit linéaire en l'absence de contrainte extérieure, sans pour cela la rendre impossible dans ces derniers cas.
Le perfectionnement des méthodes théoriques et du calcul électronique conduit à l'heure actuelle à un traitement direct satisfaisant de l'édifice global, dans les cas où les édifices A–H et B ne sont pas trop volumineux. Un certain nombre de travaux ont été faits dans ce sens, déterminant l'énergie du système en fonction des divers paramètres géométriques du système, permettant ainsi de connaître la configuration la plus stable et l'énergie correspondante. Les associations du type O–H...O et O–H...N ont surtout été étudiées. Les calculs montrent bien que le système le plus stable correspond à l'alignement des noyaux A, H et B. Les énergies obtenues sont en très bon accord avec l'expérience. On vérifie aussi que les distances A–H sont légèrement augmentées, mais qu'on peut encore, malgré tout, considérer qu'il existe une paire d'électrons pratiquement localisée entre les noyaux A et H, c'est-à-dire parler encore de la liaison A–H. Mais les calculs indiquent toutefois un léger transfert d'électrons, de la paire libre B, vers la liaison A–H.
Un cas particulier intéressant est celui où les groupements A et B sont électroniquement identiques, comme dans l'ion (FHF)- ou dans l'association (H3N–H–NH3)+. L'expérience montre, en accord avec le calcul, que dans (FHF)- le proton est à égale distance des noyaux fluor. Les caractéristiques de la liaison F–H isolée ont complètement disparu. On ne peut plus parler d'association par liaison hydrogène. On est en présence d'un édifice nouveau qu'il faut nécessairement considérer dans son ensemble. En revanche, dans (H3N–H–NH3)+ , le proton n'est pas situé à égale distance des azotes mais peut osciller entre deux positions symétriques.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André JULG : professeur émérite à l'université de Provence
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule. -
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
...nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques particulières. Du fait de ces interactions, des groupes R, éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés dans la structure spatiale et constituer, par exemple, le centre réactif... -
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...3- n'ont pu être caractérisés. L'ion Sb5+ n'existe pas, mais Sb3+ est connu, ce qui n'est pas le cas de son homologue arsénié. Comme dans le cas de l'arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales... - Afficher les 38 références
Voir aussi
- HYDROGÈNE LIAISON
- INTERACTIONS MOLÉCULAIRES
- EAU, physico-chimie
- TEMPÉRATURE DE FUSION
- RMN (résonance magnétique nucléaire), physico-chimie
- DIFFRACTION PAR LES CRISTAUX
- HYDROXYLE ou OXHYDRYLE
- INTRAMOLÉCULAIRES FORCES
- THERMODYNAMIQUE CHIMIQUE
- POLARISATION, chimie
- ASSOCIATION MOLÉCULAIRE
- CRISTAL MOLÉCULAIRE
- MISCIBILITÉ
- ÉNERGIE DE LIAISON
- STABILITÉ, chimie
- TEMPÉRATURE D'ÉBULLITION