LIAISONS CHIMIQUES Liaisons biochimiques faibles
La biologie a vu s'effacer depuis le début de ce siècle ce qui la séparait de la physique du fait que l'on s'est accordé à reconnaître qu'une modélisation en termes physico-chimiques pourrait, sans doute, expliquer les architectures et les processus qui caractérisent le vivant. Et plus particulièrement, c'est à la fin du premier quart du siècle que la description d'édifices atomiques complexes, les macromolécules, est venue faire le lien entre le monde quasi minéral, associé à l'image du cristal, qu'offrait la chimie, et le monde mouvant et associé à l'image de la colle que donnait le protoplasme cellulaire.
À la suite d'expériences permettant de proposer des théories représentatives de ce que peuvent être les macromolécules (principalement l'ultracentrifugation, avec Svedberg, et l'électrophorèse, avec Tiselius), le second thème (celui de la colle) se vit remplacé par une interprétation des macromolécules qui leur conférait une architecture statique dont le détail pouvait être analysé au moyen d'une technique qui allait révolutionner les sciences de la vie et contribuer à fonder la biologie moléculaire : la cristallographie aux rayons X. La chimie des colloïdes disparaissait donc après la guerre, tandis que de nombreux prix Nobel venaient conforter une certaine conception « cristalline » de la biochimie.
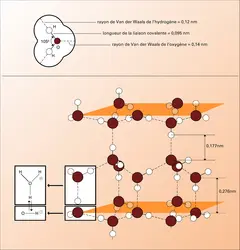
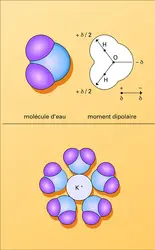
Cependant, devant l'évidence du rôle des phénomènes dynamiques de la vie, mouvements, régulations diverses, on a dû admettre qu'une image rigide n'était qu'un instantané très partiellement représentatif. Et la nature des contraintes physiques invoquées dans la genèse des macromolécules a été réévaluée. On sait, en effet, que ces édifices polyatomiques complexes ne prennent pas leur forme seulement à cause des liaisons chimiques covalentes qui associent fermement les atomes les uns aux autres, mais aussi grâce à une famille de liaisons, d'influence souvent négligeable dans les petites molécules et qu'on classe sous le nom de liaisons faibles. Ces liaisons, dont nous verrons plus loin la nature et la contribution, mettent en jeu de façon primordiale l'eau, solvant universel dans lequel sont dissoutes les molécules des êtres vivants.
Par ailleurs, les descriptions des phénomènes biologiques au niveau moléculaire ont fait de plus en plus appel au langage d'une physique particulière, la thermodynamique, qui s'attache à la description formelle des échanges d'énergie et d' entropie, à partir d'un certain nombre de principes posés comme postulats. Parmi ceux-là, le deuxième principe rend compte de l'observation courante qui montre que s'il est aisé de transformer du travail en chaleur, l'inverse est beaucoup plus difficile. Du point de vue formel, cela se traduit par le fait que l'entropie d'un système isolé ne peut que croître.
À la suite de cette première conclusion, il était donc légitime de chercher à représenter l'entropie d'un système non plus de façon globale, mais en prenant en compte les éléments microscopiques du système considéré. C'est à Boltzmann que revient le mérite des premières tentatives allant dans ce sens. Malheureusement, la complexité de la description est telle que l'étude fine de l'entropie repose sur l'analyse de cas particuliers et demande en outre de recourir à des méthodes impliquant des hypothèses supplémentaires par rapport aux hypothèses de départ (par exemple, l'analyse statistique). Elle demande enfin le choix d'un niveau de description minimal, et le résultat du calcul de l'entropie d'un système dépend de ce choix. L'étude la plus détaillée faite par Boltzmann concerne ainsi le cas des gaz parfaits, systèmes extrêmement simplifiés dans lesquels des atomes interagissent simplement par collision. Dans ce cas limite, le deuxième principe de la thermodynamique se traduit[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Antoine DANCHIN : directeur de recherche au CNRS, professeur à l'Institut Pasteur
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule. -
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 487 mots
- 6 médias
...nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques particulières. Du fait de ces interactions, des groupes R, éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés dans la structure spatiale et constituer, par exemple, le centre réactif... -
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 876 mots
- 3 médias
...3- n'ont pu être caractérisés. L'ion Sb5+ n'existe pas, mais Sb3+ est connu, ce qui n'est pas le cas de son homologue arsénié. Comme dans le cas de l'arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales... - Afficher les 38 références