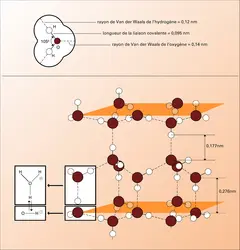
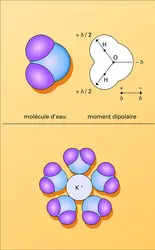
LIAISONS CHIMIQUES Liaisons biochimiques faibles
Liaisons faibles et activité biochimique
Nous prendrons comme exemple le cas de la catalyse enzymatique, pour laquelle les contributions énergétiques en jeu sont très faibles, avant d'évoquer les autres types d'activité, rattachés à de plus importantes modifications thermodynamiques.
Cas de la catalyse enzymatique
Les enzymes sont des protéines exerçant de façon très spécifique une fonction catalytique dans les réactions qui servent à l'élaboration des maillons nécessaires pour l'édification de l'architecture cellulaire, ou pour le métabolisme général de la cellule (production et utilisation d'énergie, à partir des sources de carbone et d'azote, ou encore des photons de la lumière visible). Comme tout catalyseur, une enzyme n'intervient dans la réaction que pour en accélérer la vitesse et sans être consommée au cours du processus d'activation. Ce qui est important, par conséquent, c'est la vitesse de rotation des substrats et des produits de la réaction au site catalytique de l'enzyme.
Spécificité des réactions
Dans les cas les plus simples, c'est l'architecture locale de ce site qui définit l'affinité des substrats pour l'enzyme et la vitesse de la réaction, et, dans ce cas, la configuration spatiale de l'enzyme fluctue extrêmement peu. La réaction enzymatique n'est alors régulée que par les concentrations relatives des substrats transformés et des produits obtenus. Le site catalytique est constitué par une cavité particulière de l'enzyme où les substrats pénètrent et s'arrangent de telle manière qu'ils donnent lieu à une réaction chimique dont les produits ont une architecture bien ajustée à la conformation locale de la cavité. Toute la spécificité de l'enzyme provient alors de ce que sa structure tertiaire lui permet de constituer un site catalytique à la forme bien définie : comme celle d'un moule.
Régulation allostérique
On sait que l'une des caractéristiques les plus remarquables du vivant est le maintien de l' homéostasie de l'individu (c'est-à-dire son retour à l'équilibre après un écart accidentel). En fait, cette caractéristique n'est pas seulement vraie au niveau de l'organisme tout entier mais est déjà bien visible à l'échelle moléculaire lorsqu'on considère la régulation des phénomènes biochimiques. En raison des contraintes agissant dans le maintien homéostatique de l'individu, qui se reflètent par exemple dans l'exigence du maintien d'une concentration déterminée d'une molécule, alors que des fluctuations importantes peuvent exister dans les concentrations de ses précurseurs et de ses dérivés, on conçoit qu'il existe des régulations particulières des activités enzymatiques. Et souvent, en effet, les activités catalytiques déployées par les enzymes sont ajustées de façon fine, de telle manière que le produit de la réaction soit formé à une concentration adaptée à la demande. Un des cas connus concerne la régulation allostérique dans laquelle l'activité d'une enzyme se trouve réglée par la concentration de divers effecteurs (positifs ou négatifs), fonctionnellement reliés à la réaction catalysée par l'enzyme, mais sans rapport architectural nécessaire avec les substrats ou les produits de la réaction.
Dans ces régulations de l'activité enzymatique, et plus particulièrement dans le cas de la régulation allostérique, la contribution des liaisons faibles est d'une importance cruciale. En effet, on a montré, dans les exemples les plus simples, que les enzymes allostériques sont des protéines constituées de plusieurs chaînes polypeptidiques (sous-unités) identiques, associées entre elles en une structure quaternaire grâce à des liaisons faibles (ioniques, appelées alors ponts salins, hydrogène, et aussi d'une contribution[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Antoine DANCHIN : directeur de recherche au CNRS, professeur à l'Institut Pasteur
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 364 mots
- 7 médias
Le caractère acide d'une molécule HA repose principalement sur la nature de la liaison chimique entre H et le reste A de la molécule. -
ADSORPTION
- Écrit par Xavier DUVAL
- 4 819 mots
- 2 médias
En chimisorption, les liaisons dans les molécules sont profondément modifiées par suite de la formation de liaisons chimiques avec l'adsorbant. L'objectif des recherches concerne principalement la description des espèces adsorbées et l'étude de leur stabilité, en relation avec leur rôle essentiel d'intermédiaires... -
AMINOACIDES ou ACIDES AMINÉS
- Écrit par Encyclopædia Universalis et Pierre KAMOUN
- 3 486 mots
- 6 médias
...nettement les acides aminés les uns des autres en leur conférant des propriétés physico-chimiques particulières. Du fait de ces interactions, des groupes R, éloignés les uns des autres dans la chaîne ou les chaînes, peuvent être rapprochés dans la structure spatiale et constituer, par exemple, le centre réactif... -
ANTIMOINE
- Écrit par Encyclopædia Universalis et Jean PERROTEY
- 3 875 mots
- 3 médias
...3- n'ont pu être caractérisés. L'ion Sb5+ n'existe pas, mais Sb3+ est connu, ce qui n'est pas le cas de son homologue arsénié. Comme dans le cas de l'arsenic, deux principaux modes de liaison sont possibles pour les composés trivalents, avec comme conséquence des propriétés structurales... - Afficher les 38 références