MAGNÉSIUM
Article modifié le
Propriétés physico-chimiques
Caractéristiques physiques
Le magnésium a pour masse atomique 24,312. Il existe trois isotopes naturels, stables, de nombres de masse 24 (78,99 p. 100), 25 (10,00 p. 100) et 26 (11,01 p. 100). Seize isotopes artificiels radioactifs et de nombres de masse allant de 19 à 23 et de 27 à 37 ont été synthétisés. La structure électronique à l'état fondamental est 1s2 ; 2s2, 2p6 ; 3s2 ; le rayon atomique vaut 0,160 nm.
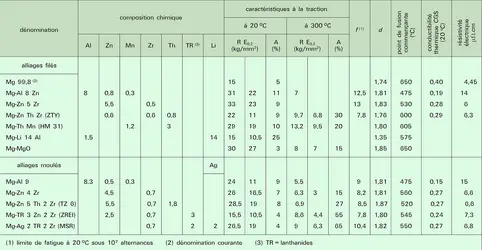
Le tableau (partie droite) présente les caractéristiques physiques principales du magnésium commercial à 99,8 p. 100 et de quelques alliages.
C'est le plus léger des matériaux métalliques produits à échelle industrielle. À volume égal, l'aluminium pèse 1,55 fois plus, le titane 2,55, le fer 4,5 et le cuivre 5. Cette propriété est à la base d'un certain nombre d'applications.
La conductibilité thermique est relativement élevée. Le magnésium vient au quatrième rang des métaux industriels derrière l'argent, le cuivre et l'aluminium et avant le zinc, le nickel, le fer et le titane. Les alliages et notamment ceux au zinc, zirconium et thorium conservent une conductibilité thermique relativement élevée qui favorise les utilisations à chaud.
La section de capture des neutrons thermiques est particulièrement favorable pour le magnésium. Seul le béryllium présente un coefficient plus faible. Le zirconium et l'aluminium sont trois fois plus absorbants, le fer neuf fois plus. Cette propriété a été largement exploitée dans la fabrication des gaines de combustibles de la filière uranium naturel-graphite-dioxyde de carbone.
Caractéristiques chimiques
Dans la classification périodique, le magnésium appartient au groupe II A ; il est caractérisé par le seul degré d'oxydation + II ; l'ion Mg2+ est incolore et de saveur amère.
Les propriétés chimiques sont dominées par la très grande réactivité du métal qui se rapproche, sur ce point, des métaux alcalino-terreux. La chaleur d'oxydation est très grande, ce qui en fait un réducteur très énergique d'un grand nombre de chlorures métalliques. Cette réaction est utilisée en métallurgie pour la production de métaux tels que le titane, le zirconium, l'uranium... La magnésie (MgO) ne constitue pas, en général, pour le métal, une barrière protectrice efficace vis-à-vis de la progression de l' oxydation. Dans le dioxyde de carbone sec et sous pression, la vitesse d'oxydation du magnésium et de l'alliage magnésium-zirconium est du type parabolique : le gain de poids est de l'ordre de 50 mg/cm2 pendant les mille premières heures et de l'ordre de 100 mg/cm2 pendant les trois mille heures suivantes. Dans certains milieux (fluor sec, gaz sulfureux), il se forme un film protecteur, même au-delà du point de fusion.
Dans l'échelle des potentiels, le magnésium est le moins noble des métaux et alliages industriels (potentiel de dissolution : — 1,60 V). Il réagit avec la plupart des acides en libérant de l'hydrogène :
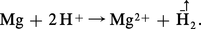
Sous forme de poudre, le magnésium brûle avec une lumière intense, riche en ultraviolets ; il continue même à brûler dans une atmosphère d'anhydride carbonique. Il donne également des réactions violentes avec les éléments non métalliques pour peu que ceux-ci soient oxydants (halogènes, soufre, azote et phosphore). Les composés formés sont assez nettement ioniques avec les éléments les plus fortement électronégatifs (chlore, fluor...). L'iodure, au contraire, a une structure lamellaire du type de celle de l'iodure de cadmium. L'ion Mg2+ par son rayon de 0,065 nm s'apparente plus aux ions des métaux de transition (Fe2+ : 0,076, Co2+ : 0,074, Ni2+ : 0,072) qu'aux ions alcalino-terreux (entre 0,1 et 0,14 nm).
Composés
La magnésie MgO est une poudre blanche obtenue par calcination de l'hydroxyde Mg(OH)2 ou de la magnésite MgCO3. Elle est isotype d'un grand nombre d'oxydes des métaux de transition comme elle de structure NaCl. C'est un excellent produit réfractaire qui sert à faire des creusets de laboratoire et que l'on peut agglomérer sous forme de briquettes pour les revêtements de fours métallurgiques à caractère basique.
Le sulfate existe dans la nature à l'état de monohydrate ( kiesérite) et à l'état heptahydraté (sel d'Epsom). Ce dernier est le chef de file de la série dite magnésienne de formule générale [M(H2O)6]SO4.H2O, dans laquelle M représente un grand nombre d'éléments divalents de rayon ionique inférieur à 0,1 nm, le manganèse, le zinc ou le chrome. Il appartient également à une famille de nombreux sels doubles de formule générale M2M′(SO4)2.6H2O dans lequel M est un « métal » monovalent (K, Rb, Cs, NH4) et M′ un « métal » divalent (Mg, Fe, Co, Ni).
En chimie organique, la réaction de Grignard est très utilisée pour la production des organomagnésiens. De formule générale RMgX dans laquelle R est un radical alcoyle ou aryle et X un halogène (iode, brome ou chlore), ces réactifs sont encore aujourd'hui parmi les plus précieux en synthèse organique.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Maurice HARDOUIN : ingénieur à la société Tréfimétaux G.P.
- Michel SCHEIDECKER : Ingénieur, chef de la Division des études et fabrications nucléaires du département des recherches et produits avancés, société Tréfimétaux G.P.
Classification
Médias
Autres références
-
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 363 mots
- 5 médias
Lemagnésium et l'aluminium sont à la base d'alliages légers, dont certains sont très courants, comme le duralumin, déjà évoqué. Ils sont rencontrés dans les industries automobile et aéronautique. Les avions sont également de gros consommateurs, pour leurs structures, d'un alliage à base de titane,... -
BÉRYLLIUM
- Écrit par Jean-Paul CARRON , Robert GADEAU et Jean PERROTEY
- 5 411 mots
- 6 médias
Onchauffe à 1 300 0C pendant 3 à 4 heures, dans un four dont le creuset est en graphite, des morceaux de magnésium et du fluorure de béryllium. Le béryllium fourni par la réaction se rassemble, par fusion, en petites billes. On transvase la charge dans un autre creuset de graphite ; après solidification,... -
EAU DURETÉ DE L'
- Écrit par Cyrille GOMELLA
- 304 mots
-
EPSOMITE
- Écrit par Yannick LOZAC'H
- 312 mots
Se présentant généralement en croûtes, en efflorescences ou en groupements de fines aiguilles, ce sulfate de magnésium hydraté cristallise dans le système orthorhombique. Les cristaux peuvent paraître tétragonaux de par la présence d'un angle voisin de 900 entre les faces du prisme....
- Afficher les 7 références
Voir aussi
- MINÉRALE CHIMIE
- ORGANOMAGNÉSIENS COMPOSÉS
- CAPTURE DE NEUTRONS
- COMBUSTIBLE NUCLÉAIRE
- OXYDATION
- DÉFORMATIONS, mécanique
- SULFATE DE MAGNÉSIUM
- RÉDUCTEUR, chimie
- DOLOMITE
- CARNALLITE
- DOLOMIES
- IG FARBEN (Interessen Gemeinschaft Farbenindustrie)
- DOW CHEMICAL CO. PROCÉDÉ
- MAGNÉSITE
- MAGNÉSIE (oxyde de magnésium)
- KIÉSÉRITE
- PIDGEON PROCÉDÉ
- MAGNÉTHERM PROCÉDÉ
- MÉTALLOTHERMIE
- NORSK HYDRO PROCÉDÉ
- ÉLECTROMÉTALLURGIE
- GRIGNARD RÉACTION DE
- EAU DE MER
- CHLORURE DE MAGNÉSIUM
- LAITIER, métallurgie
- RÉDUCTION, chimie
- ALCALINO-TERREUX
- ÉLECTROLYSE
- USINAGE