MALADIES MOLÉCULAIRES
Article modifié le
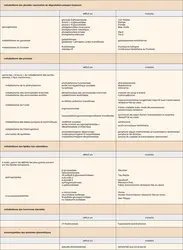
Les enzymopathies
C'est en 1908 que, pour la première fois, un médecin d'Oxford, Archibald Garrod, fait la corrélation entre « maladie », « enzyme » et « génétique ». Il observe dans diverses familles la fréquence de l'alcaptonurie (cette affection bénigne se caractérise par un noircissement rapide des urines à l'air). Il constate la distribution familiale de cette affection et sa haute fréquence en cas de mariage consanguin. Il rapproche ces phénomènes des lois de Mendel, alors récemment redécouvertes, et fait l'hypothèse que cette anomalie est due à une déficience enzymatique.
Trente ans plus tard, en 1941, les travaux de Beadle et Tatum leur permettent d'énoncer le principe : « un gène, une enzyme », et d'affirmer ainsi que toutes les étapes des processus biochimiques s'effectuent sous un contrôle génétique. Par conséquent, la mutation d'un gène provoque l'incapacité de la cellule à effectuer la réaction correspondante.
La localisation des anomalies biochimiques
La lésion peut se situer à tous les niveaux au cours de l'opération intracellulaire qu'est la biosynthèse des protéines.
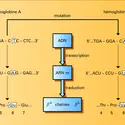
Le niveau de l'ADN est probablement le plus fréquemment en cause. Il est également le plus facile à comprendre ; on peut observer :
– une délétion du gène, complète ou non ; si le gène n'est pas présent, aucune protéine ne peut être synthétisée ;
– une anomalie autre qu'une délétion : c'est le plus souvent une mutation, remplacement d'une base par une autre. Cela peut aboutir à un signal de terminaison précoce interrompant la synthèse de la protéine. Le plus souvent cela aboutit au remplacement dans la chaîne de la protéine d'un acide aminé par un autre. Une enzyme porteuse de cette mutation ponctuelle peut rester fonctionnelle, mais, si la mutation siège dans une zone indispensable à son action (le site actif), l'enzyme aura perdu son activité.
Au niveau de l'ARN deux types d'anomalies peuvent s'observer :
– des anomalies de maturation : le produit primaire de transcription ne sera pas transformé en messager fonctionnel ;
– des anomalies de stabilité du messager, détruit avant d'avoir pu remplir sa fonction.
Lorsque la protéine est synthétisée en quantité normale, plusieurs accidents peuvent en prévenir l'action :
– certaines mutations altèrent gravement la stabilité de l'enzyme qui est rapidement détruite ;
– dans certains cas, la « finition » ne peut se faire ; l'enzyme sera incapable de gagner son lieu d'action définitif ou d'y exercer celle-ci.
Les méthodes d'étude des anomalies
Ces méthodes sont nombreuses et visent à reconnaître l'enzymopathie puis à en analyser les caractères.
Le premier temps est celui d'identification : il reconnaît le déficit par un dosage de l'enzyme soit dans les tissus, soit dans le sérum, plus facile d'accès, mais qui souvent ne reflète qu'imparfaitement l'activité tissulaire.
S'il existe une activité résiduelle, on en analysera les caractères comparés à ceux d'un sujet normal : étude de la constante d'affinité de l'enzyme, de la thermostabilité, du pH optimal, de l'action sur des substrats secondaires, etc. À l'électrophorèse sur divers supports et à la chromatographie, y compris la chromatographie d'affinité, est venue s'ajouter l' électrofocalisation (électrophorèse en présence d'amphotères permettant une séparation très fine en fonction du point isoélectrique). L'électrophorèse (en milieu dissociant) en gradient d'acrylamide permet d'évaluer le poids moléculaire.
Si au cours d'une enzymopathie on ne peut détecter aucune activité au niveau d'un chaînon du métabolisme, il est possible de rechercher s'il existe une[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Claude DREYFUS : professeur honoraire à la faculté de médecine Cochin-Port-Royal
- Fanny SCHAPIRA : directeur de recherche honoraire au C.N.R.S.
Classification
Média
Autres références
-
NOTION DE MALADIE MOLÉCULAIRE
- Écrit par Dominique LABIE
- 252 mots
- 1 média
Comme d'autres scientifiques, Vernon Ingram avait quitté l'Europe centrale pour la Grande-Bretagne, Londres, puis Cambridge. C'est là qu'il apporta un complément décisif à la mise en évidence par Linus Pauling en 1949 d'une migration électrophorétique anormale de l'...
-
ÉLASTINE
- Écrit par William HORNEBECK et Ladislas ROBERT
- 1 941 mots
- 2 médias
De nombreuses pathologies du collagène ont été définies en fonction desanomalies moléculaires résultant de modifications qualitatives et quantitatives aux différentes étapes de la synthèse et de la maturation de cette molécule. Une classification analogue a été proposée pour l'élastine par L.... -
HÉMATOLOGIE
- Écrit par Jean BERNARD et Michel LEPORRIER
- 8 479 mots
- 1 média
...de l'hémoglobine et, éventuellement, une maladie mortelle. Ainsi se trouve à la fois définie et illustrée la remarquable conception de la pathologie moléculaire de Pauling. Les douleurs et les malaises, la fièvre, tous les tourments que souffre le patient, les hypertrophies et les atrophies constatées... -
HÉMOGLOBINOPATHIES
- Écrit par Michel COHEN-SOLAL et Jean-Claude DREYFUS
- 3 854 mots
- 6 médias
Les hémoglobines anormales sont responsables de maladies dont la cause est génétique et l'interprétation moléculaire, ce qui a permis à L. Pauling de parler de « maladie moléculaire ». Les anomalies observées sont de deux types : quantitatives et qualitatives. -
INGRAM VERNON MARTIN (1924-2006)
- Écrit par Encyclopædia Universalis
- 184 mots
Biologiste allemand installé aux États-Unis. Né en Allemagne, émigré avec ses parents en 1938 au Royaume-Uni, il mène des études de chimie au Birbeck College de l'universitéde Londres où il obtient un doctorat de chimie organique en 1949. Il travaille ensuite aux États-Unis avec Moses Kunitz sur la...
- Afficher les 8 références
Voir aussi
- LACTOSE
- ENZYMES
- MUTATIONS DYNAMIQUES ou MALADIES À EXPANSION DE TRIPLETS
- CHROMOSOME X FRAGILE SYNDROME DU
- INSUFFISANCE HÉPATIQUE
- BILIRUBINE
- ADN RÉPARATION DE L'
- ANTI-ONCOGÈNES ou GÈNES SUPPRESSEURS DE TUMEURS
- HÉRÉDITAIRES MALADIES ou MALADIES GÉNÉTIQUES
- ARN MESSAGER ou ARNm
- DRÉPANOCYTOSE ou ANÉMIE FALCIFORME
- NÉONATOLOGIE
- HYPOGLYCÉMIE
- ENFANT MALADIES DE L'
- PÉDIATRIE
- PHYSIOPATHOLOGIE
- TRANSFÉRASES
- NICOTINAMIDE ADÉNINE DINUCLÉOTIDE PHOSPHATE (NADP)
- ISOZYMES
- GARROD sir ARCHIBALD EDWARD (1857-1936)
- DOSAGE ENZYMATIQUE
- MÉTABOLISME DES GLUCIDES
- GLYCURONYL TRANSFÉRASE
- HÉRÉDITÉ AUTOSOMIQUE RÉCESSIVE
- HÉRÉDITÉ FAMILIALE
- MÉTABOLIQUES MALADIES
- HYPERBILIRUBINÉMIE
- INACTIVATION DU CHROMOSOME X
- THÉRAPIE GÉNIQUE
- THALASSÉMIE
- HÉMATIE ou GLOBULE ROUGE ou ÉRYTHROCYTE
- ICTÈRE ou JAUNISSE
- GLUCOSE
- GALACTOSE
- FRUCTOSE
- GONOSOMES ou CHROMOSOMES SEXUELS ou HÉTÉROCHROMOSOMES
- LIAISON GÉNÉTIQUE
- PROTÉINES BIOSYNTHÈSE DES
- GALACTOSÉMIE CONGÉNITALE
- CATARACTE, pathologie
- RÉCESSIVITÉ, génétique
- HÉRÉDITÉ LIÉE AU SEXE
- DIAGNOSTIC PRÉNATAL
- ANTÉNATOLOGIE
- ENZYMOPATHIES
- EXPÉRIMENTATION ANIMALE
- GÉNÉTIQUE MOLÉCULAIRE
- ALDOLASES
- ÉLECTROFOCALISATION
- DUCHENNE MYOPATHIE DE
- ANTIPALUDÉENS MÉDICAMENTS
- ONCOGÈNES
- INTOLÉRANCE ALIMENTAIRE
- PROTÉINES
- MÉDECINE PRÉVENTIVE ET PRÉVENTION MÉDICALE
- DYSTROPHINE
- DYSTROPHIE MUSCULAIRE
- DÉFICITS ENZYMATIQUE & MÉTABOLIQUE
- GLUCOSE-6-PHOSPHATE DÉSHYDROGÉNASE (G-6-PD)