MANGANÈSE
Article modifié le
Propriétés
Caractéristiques physiques
Le manganèse existe sous quatre formes allotropiques α, β, γ et δ dont les températures de transformation réversibles sont :

La phase γ se forme au cours du dépôt électrolytique du manganèse et se transforme rapidement en la phase α, stable à température ordinaire.
La couche électronique d, à moitié remplie, du manganèse est responsable de l'anomalie systématique des constantes physiques et mécaniques de cet élément par rapport à celles des autres éléments de transition de la quatrième période de la classification. Ces constantes, relatives à la variété α, sont consignées dans le tableau 1.
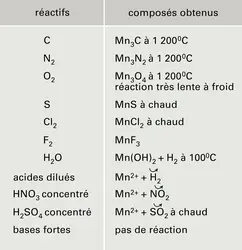
Propriétés chimiques
Le tableau 2 indique quelques réactions du manganèse. La chimie, en solution aqueuse, du manganèse et de ses combinaisons à ses divers degrés d'oxydation peut être prévue à l'aide du diagramme potentiel E = f (pH) de la figure 2. Ce diagramme a été calculé à partir des valeurs thermodynamiques des potentiels normaux d'oxydoréduction du tableau 1. Le manganèse y apparaît avec les degrés d'oxydation 0 (métal), II (composés manganeux), III (composés manganiques), IV (bioxyde), VI (manganates) et VII (permanganates).
On peut constater sur ce diagramme que :
– Le métal Mn(0) est très réducteur : il sera attaqué par l'eau (lentement à froid) et par les acides dilués selon la réaction 1, puisque son domaine de stabilité est situé au-dessous de celui de l'eau dont la limite inférieure est indiquée par la ligne a du diagramme. A fortiori, il réagira sur l'oxygène dont le potentiel normal est encore plus élevé (ligne b), mais, contrairement aux métaux qui le précèdent dans la quatrième période, le manganèse n'est pas protégé par une couche d'oxyde.
– À pH > 8 et E < 0, les ions Mn2+ sont précipités à l'état d'hydroxyde Mn(OH)2 incolore, qui est oxydé sous forme de Mn3O4, Mn2O3 ou MnO2 bruns et noirs, selon la force de l'oxydant antagoniste. La première de ces réactions est du type 2. Ce brunissement de Mn(OH)2 est à la base du contrôle de l'oxygène dans les gaz.
– Le dioxyde MnO2 peu soluble se dissout en milieu acide en présence de réducteur selon la réaction 3 :

Inversement, Mn2+ est oxydé en MnO2 en présence d'un oxydant dont le potentiel du couple rédox est supérieur à 1,23 à pH = 0 et à 0,1 à pH = 14.
– Le potentiel normal du couple Mn3+/Mn2+ (équation 4) étant supérieur à celui du couple Mn4+/Mn2+ (équation 3), les ions Mn3+ sont instables en solution et se dismutent suivant :

– À pH > 13, MnO2 s'oxyde en manganate vert en présence d'oxydants énergiques (E > 0,6 à pH = 13), selon l'équilibre 7. En milieu acide, MnO42— se dismute suivant la réaction 8 :

Ce fait est à la base des liqueurs dites « caméléon minéral » : vert ⇌ violet. – L 'ion permanganate MnO4—, violet, est un oxydant puissant aussi bien en milieu acide (réaction 5) qu'en milieu alcalin (réaction 6). Théoriquement, MnO4— devrait oxyder l'eau (ligne b) avec dégagement d'oxygène ; mais, en milieu neutre et à l'abri de la lumière, la vitesse de cette réaction est pratiquement nulle, d'où l'utilisation des solutions de permanganate dans les dosages redox (manganimétrie).
Données analytiques
La meilleure méthode de caractérisation qualitative consiste à oxyder, en milieu nitrique, les ions Mn2+ par le persulfate d'ammonium en présence d'ions Ag+ jouant le rôle de catalyseur. On peut aussi oxyder par le périodate de potassium sans catalyseur. En chauffant un peu, on obtient la coloration violette caractéristique des ions MnO4—. La réaction est spécifique et sensible (limite de sensibilité : 3 ppm).
Le dosage du manganèse s'effectue suivant le même principe : oxydation, en milieu nitrique, de Mn2+ en MnO4— par le persulfate en présence d'ions Ag+, ou, mieux, par le bismuthate de sodium sans catalyseur. MnO4— est alors dosé soit par volumétrie à l'aide d'une solution titrée de sulfate ferreux jusqu'à décoloration du permanganate, ou bien en présence d'un indicateur tel que l'orthophénanthroline ferreuse si la solution à doser est trop diluée, soit encore par colorimétrie de l'ion MnO4— à 530 μm. Cette dernière méthode est la meilleure au point de vue de la sensibilité et de la précision.
On peut aussi doser par polarographie : dans une solution de base de triéthanolamine, à pH = 13, il y a formation d'un complexe vert bouteille de Mn3+, dont le potentiel de demi-vague, situé à — 0,40 V, permet un dosage précis du manganèse en présence des autres métaux, le fer en particulier. Seul le cuivre est gênant.
Dans certains cas, lorsque le manganèse a pu être séparé à l'état de bioxyde, on peut calciner ce dernier à 900 0C et peser l'oxyde Mn3O4 formé.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bernard DUBOIS : professeur à l'École nationale supérieure de chimie de Paris et à l'université de Paris-VI
- Jacques FAUCHERRE : ancien directeur du laboratoire de chimie minérale de l'université de Paris-VII, professeur honoraire de chimie
- Gil MICHARD : docteur ès sciences, professeur à l'université de Paris-VII
- Clotilde POLICAR : professeur agrégée de sciences physiques, maître de conférences à l'université de Paris-XI
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
Classification
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
Lemanganèse intervient également dans tous les aciers comme désoxydant. Dans les aciers alliés, il se comporte, dans un certain sens, comme le nickel ; il augmente la trempabilité, permet d'obtenir des aciers à structure austénitique stable. Mais il participe à la formation de carbures et se trouve... -
AIMANTS
- Écrit par Roger FONTAINE
- 6 274 mots
- 13 médias
Un autre exemple de matériau à réaction désordre-ordre se trouve, pour certaines compositions, dans les alliages manganèse-aluminium. Ainsi, l'alliage de composition 72 p. 100 Mn, 28 p. 100 Al à structure hexagonale à haute température se transforme à 700 0C en une phase tétragonale... -
CARBONATES
- Écrit par Marc DARDENNE et André JAUZEIN
- 5 052 mots
- 12 médias
Ce minéral a aussi été appelé « dialogite » à cause de l'incertitude qui régnait à l'origine sur sa composition.La substitution du fer ferreux ou du calcium au manganèse est la plus fréquente. Lorsqu'elle existe, la couleur rose (en grec, rhodochros) est caractéristique de ce minéral,... -
EAU - Approvisionnement et traitement
- Écrit par Georges BREBION , Cyrille GOMELLA et Bernard LEGUBE
- 10 058 mots
- 5 médias
Le fer et lemanganèse sont présents sous forme dissoute (réduite) dans les eaux souterraines, eaux qui sont également appauvries en oxygène et riches en anhydride carbonique. Il faut donc effectuer une aération. Pour cela, l'eau traverse un lit de percolation, constitué de matériaux naturels... - Afficher les 14 références
Voir aussi
- ENZYMES
- LIGNINE
- HYDROSPHÈRE
- CATALASE
- FERROMANGANÈSE
- SILICOMANGANÈSE
- MANGANATES
- MANGANÈSE-PEROXYDASE
- POTENTIEL D'OXYDORÉDUCTION
- EXTRACTION, métallurgie
- BIOXYDE DE MANGANÈSE
- LECLANCHÉ PILE
- ACIER, technologie
- FERRO-ALLIAGES
- HYPOMANGANATES
- DOSAGE, chimie
- LIGAND ou COORDINAT, chimie
- DEGRÉ D'OXYDATION
- OXYDATION
- OXYDANTS
- PILES & ACCUMULATEURS
- SITE ACTIF, biochimie
- PERMANGANATES
- TRANSITION MÉTAUX DE
- RÉDUCTION, chimie
- OXYDORÉDUCTIONS, biologie
- NODULES POLYMÉTALLIQUES
- SUPEROXYDE DISMUTASE
- OXYDES
- PEROXYDASES
- JAHN-TELLER EFFET
- CYCLE GÉOCHIMIQUE
- HYDROTHERMALISME OCÉANIQUE ET SOURCES HYDROTHERMALES SOUS-MARINES
- PERMANGANATE DE POTASSIUM
- COORDINATION COMPOSÉS DE