MANGANÈSE
Article modifié le
Composés
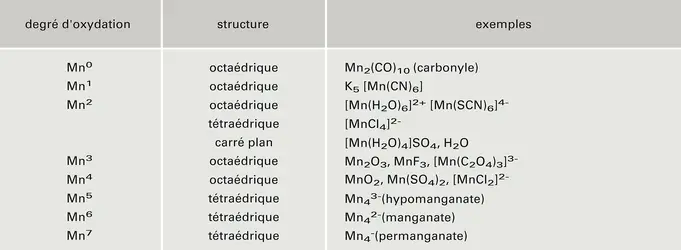
Tous les degrés d'oxydation du manganèse, de zéro à + VII, sont connus. On trouvera, dans le tableau 3, quelques exemples de composés simples ou complexes ou d'oxyanions, ainsi que leur structure en relation avec le nombre de coordination du manganèse dans ces composés.
D'une manière générale, le caractère acide de ces cations croît avec l'augmentation du degré d'oxydation (diminution du rayon et augmentation de la charge de l'ion). Ainsi, Mn(OH)2 est une base assez forte, MnO2 est amphotère et HMnO4 est un acide fort.
Signalons l'existence de trois degrés d'oxydation très instables : — I dans [Mn(CO)5]—, ainsi que — II et — III, qui correspondent à des composés extrêmement réducteurs.
Il est à noter que l'intérêt des chimistes inorganiciens et, plus particulièrement, des chimistes de coordination à l'égard des complexes du manganèse est relativement récent. Ainsi, ce n'est qu'en 1973 que le premier volume du système Gmelin concernant le manganèse est publié. On peut rappeler que l'entreprise de l'encyclopédie Gmelin, dont le but est de recenser les composés inorganiques, remonte à 1852 (signalons que le premier volume concernant le magnésium est publié en 1937). Un tel dédain peut s'expliquer par la prépondérance du degré d'oxydation II (degré d'oxydation le plus stable) et le manque de techniques immédiates de caractérisation de la géométrie pour cet état rédox. À partir du début de la décennie 1980 cependant, la multiplication des découvertes de systèmes biologiques impliquant le manganèse a mis en évidence l'importance de cet élément, ce qui n'a rien de surprenant étant donné son abondance assez élevée dans l'écorce terrestre. Cela a entraîné une recrudescence d'attention pour ce métal, ces ions et leurs complexes et fait découvrir aux chimistes tout un pan de la chimie des hauts degrés d'oxydation du manganèse (en particulier III et IV). En atteste l'accroissement du nombre de volumes du Gmelin consacré à cet ion métallique : on dénombrait en 1994 vingt et un volumes consacrés au manganèse, le plus récent datant de 1993, contre seulement huit au magnésium, le plus récent datant de 1952 !
Degré d'oxydation + II
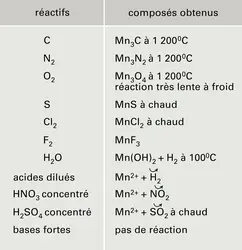
Le Mn(II) a pour structure électronique 4s0 3d5. Le degré d'oxydation +II est le plus stable des degrés d'oxydation du manganèse. Il est plus difficile à oxyder que Cr(II) et Fe(II). Les sels manganeux sont roses en solution et à l'état cristallisé. On les obtient par attaque acide du métal. Citons l'oxyde MnO ; l'hydroxyde Mn(OH)2, peu soluble, qui s'oxyde à l'air en brunissant ; les halogénures MnX2, plus ou moins hydratés ; le sulfate [Mn(H2O)6SO4]H2O, isomorphe du sel ferreux correspondant ; le carbonate MnCO3, peu soluble, isomorphe de la calcite ; le sulfure MnS, peu soluble.
Le Mn(II) a pour structure électronique 4s0 3d5. On note quelques rares exemples de complexes à spin faible avec les ligands les plus forts de la série spectrochimique. Un exemple est Mn (CN)64— (S=1/2). Mais Mn(II) est le plus souvent à spin fort avec cinq électrons non appariés (S=5/2). Quelle que soit la géométrie, l'énergie de stabilisation du champ de ligands (E.S.C.L.) est alors nulle. La géométrie est donc imposée, non par la stabilisation électronique, mais par des critères de répulsion stérique entre ligands : les géométries octaédrique et tétraédrique, qui minimisent ces interactions stériques, sont favorisées. Le Mn(II) possédant un rayon ionique assez élevé (0,097 nm pour l'espèce à spin fort en coordination octaédrique), la géométrie octaédrique sera la plus fréquente. On la rencontre dans [Mn(H2O)6]2+. Il existe aussi des exemples de complexes tétraédriques, qui sont le plus souvent des espèces anioniques du type [MnX4]2— ou [MnX3L]— (où X désigne un halogénure et L un ligand d'une autre nature). Les complexes du Mn(II) se révèlent moins stables que ceux des autres cations divalents des métaux de transition (Fe(II), Co(II), Ni(II), Cu(II) ou Cr(II)...) (leur constante de formation est plus faible). Cela peut s'expliquer par le rayon ionique plus élevé du Mn(II), par le caractère acide de Lewis plus faible et par une E.S.C.L. nulle.
Les complexes du Mn(II) possédant cinq électrons dans les cinq orbitales 3d (soit 1 électron par orbitale 3d, couches à demi-remplies), toute transition électronique s'accompagne d'un changement de spin : elles sont donc interdites. Les complexes du manganèse(II) possèdent donc des spectres d'absorption électronique très peu intenses : ils sont donc de couleur pâle, comme c'est le cas du dichlorure de manganèse(II) (rose pâle).
L'E.S.C.L. étant plus élevée pour Mn(I) et Mn(III) que pour Mn(II), il s'ensuit que les complexes manganeux pourront être facilement réduits ou oxydés (cf. réactions).
Degré d'oxydation + III
La structure électronique du Mn(III) (4s0 3d4) donne la préférence à une géométrie octaédrique, avec une E.S.C.L. de -6 Dq, déformée par une stabilisation supplémentaire due à l'effet Jahn-Teller. Le théorème de Jahn-Teller spécifie que si l'état fondamental d'une molécule non linéaire est dégénéré pour l'orbitale, alors cette molécule subira une déformation de telle sorte que la dégénérescence soit levée, ce qui stabilisera l'édifice. Ici, un unique électron est présent sur les deux niveaux eg de la symétrie octaédrique. Par abaissement de symétrie, le niveau dégénéré eg se sépare en deux niveaux non dégénérés, avec stabilisation énergétique pour l'électron concerné. Les complexes du Mn(III) sont le plus souvent à champ de ligand faible et donc de spin fort (S = 2). Contrairement au Mn(II), les transitions électroniques ne sont pas interdites par la règle de sélection sur le spin puisqu'une orbitale 3d non occupée subsiste. Une conséquence est que les complexes du Mn(III) sont fortement colorés, avec une large palette de couleurs : [Mn(acac)3]noir (acac = acétylacétonate), [MnT(OH)4]— vert bouteille (T = triéthanolamine), [Mn(C2O4)3]3—pourpre (malonates et oxalates), [Mn(CN)6]3— rouge...
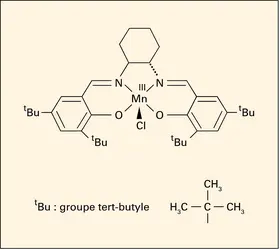
Les dérivés du Mn(III) sont peu stables et très oxydants. En solution aqueuse, ils sont le plus souvent réduits par l'eau qui se trouve oxydée en dioxygène. Au cœur des plantes, au sein du photosystème, c'est justement un cluster à quatre manganèses, impliquant les degrés d'oxydation III et IV, qui est le siège de l'oxydation de H2O en O2. Leur caractère oxydant est utilisé en chimie organique : le catalyseur de Jacobsen (fig. 3) est ainsi utilisé pour l'époxydation asymétrique d'alcènes.
Degré d'oxydation + IV
MnO2 est un oxyde très peu soluble (Ks = 10—56) et légèrement amphotère. Ainsi, dans la soude 10 N, il se comporte comme un acide très faible et forme une manganite peu soluble, Na2MnO3 ; c'est aussi une base très faible, mais le cation, Mn(IV), trop acide, ne peut exister dans l'eau. MnO2 est aussi oxydant. C'est à ce titre qu'il est utilisé comme dépolarisant cathodique des piles sèches du type Leclanché et qu'il réagit sur HCl (découverte du chlore, Carl Wilhelm Scheele, 1774).
Très divisé, MnO2 possède un pouvoir adsorbant important, vis-à-vis de K+ et de Ba2+ en particulier, et des propriétés de catalyseur d'oxydation : décomposition de H2O2 ou de KClO3 (préparation de l'oxygène). Son activité varie avec la nature des variétés allotropiques : pyrolusite quadratique, ramsdellite orthorhombique, psilomélane et cryptomélane monocliniques. Toutes ces variétés sont paramagnétiques, avec un spin S = 3/2.
La chimie du Mn(IV) est restée longtemps réputée pauvre, limitée à MnO2 et à quelques dérivés, MnX4 ou [MnX6]2— (où X est un halogénure). Cependant, la découverte d'entités mixtes Mn(III)-Mn(IV) au site actif de nombreux systèmes biologiques (catalase, centre de dégagement du dioxygène du photosystème...) a renouvelé l'intérêt des chimistes pour ces espèces. Les complexes polymétalliques impliquant les Mn(III) et Mn(IV) sont aujourd'hui l'objet d'une recherche intensive et ont révélé une chimie et une spectroscopie très riches.
Degré d'oxydation + V
L' ion hypomanganate MnO43—, bleu intense, semble être le seul représentant de cet état d'oxydation. La réduction du permanganate par le sulfite de sodium en milieu très alcalin fournit une solution bleue d'où cristallise le sel : Na3MnO4.10H2O. Très instable, MnO43— n'existe qu'en solution très alcaline et se dismute, par dilution, en MnO42— vert et MnO2 précipité.
Degré d'oxydation + VI
Par fusion alcaline oxydante (KOH + KClO3) d'un sel manganeux ou du bioxyde, on obtient l'ion manganate (MnO42—) de couleur verte, seul représentant connu de cet état d'oxydation. L'ion MnO42— n'est stable qu'en solution alcaline et se dismute par dilution ou acidification en MnO2 et MnO4— (réaction 8). C'est un oxydant énergique (réaction 7). Ses sels alcalins sont isomorphes des sulfates et chromates. Leur moment magnétique correspond à un électron célibataire au niveau d.
Degré d'oxydation + VII
L'ion permanganate MnO4—, violet intense, est obtenu par électrochimie, procédé qui a supplanté le procédé chimique d'oxydation du manganate par le chlore : MnO42— → MnO4— + e— (E0 = + 0,6 V).
Dans une première étape, l'ion manganeux de la pyrolusite est oxydé par le dioxygène de l'air en ion manganate, en présence de potasse. MnO2+ 1/2 O2 + 2 OH— → MnO42— + H2O.
Ensuite, dans une seconde étape, la solution de manganate est oxydée en permanganate, en présence de potasse, à l'anode d'un électrolyseur. Le permanganate de potassium est obtenu par cristallisation de la solution.
Les permanganates sont très utilisés comme agents oxydants de la chimie préparative et analytique. Les réducteurs les font passer à l'état + II en solution acide (réaction 5), et à l'état + IV en solution alcaline (réaction 6).
L'acide correspondant HMnO4 est connu en solution. Acide fort, ses sels des métaux alcalins ne subissent donc pas l'hydrolyse. On connaît aussi l'anhydride Mn2O7, obtenu par déshydratation de HMnO4 avec l'acide sulfurique concentré. C'est un liquide huileux, vert olive, explosif.
Quoique ne possédant pas d'électrons célibataires, l'ion MnO4— présente cependant un faible paramagnétisme. Ses sels sont isomorphes des perchlorates, ce qui conduit à attribuer au manganèse une structure électronique sp3 (tétraédrique), identique à celle du chlore dans l'ion ClO4—. Cette structure s'accorde aussi avec le fait que KMnO4 donne une solution solide avec BaSO4. La précipitation de BaSO4 en présence d'ions MnO4— constitue, d'ailleurs, une réaction analytique spécifique du baryum, réaction fondée sur le fait que les cristaux mixtes roses formés ne sont pas décolorés par les réducteurs usuels.
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bernard DUBOIS : professeur à l'École nationale supérieure de chimie de Paris et à l'université de Paris-VI
- Jacques FAUCHERRE : ancien directeur du laboratoire de chimie minérale de l'université de Paris-VII, professeur honoraire de chimie
- Gil MICHARD : docteur ès sciences, professeur à l'université de Paris-VII
- Clotilde POLICAR : professeur agrégée de sciences physiques, maître de conférences à l'université de Paris-XI
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
Classification
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
Lemanganèse intervient également dans tous les aciers comme désoxydant. Dans les aciers alliés, il se comporte, dans un certain sens, comme le nickel ; il augmente la trempabilité, permet d'obtenir des aciers à structure austénitique stable. Mais il participe à la formation de carbures et se trouve... -
AIMANTS
- Écrit par Roger FONTAINE
- 6 274 mots
- 13 médias
Un autre exemple de matériau à réaction désordre-ordre se trouve, pour certaines compositions, dans les alliages manganèse-aluminium. Ainsi, l'alliage de composition 72 p. 100 Mn, 28 p. 100 Al à structure hexagonale à haute température se transforme à 700 0C en une phase tétragonale... -
CARBONATES
- Écrit par Marc DARDENNE et André JAUZEIN
- 5 052 mots
- 12 médias
Ce minéral a aussi été appelé « dialogite » à cause de l'incertitude qui régnait à l'origine sur sa composition.La substitution du fer ferreux ou du calcium au manganèse est la plus fréquente. Lorsqu'elle existe, la couleur rose (en grec, rhodochros) est caractéristique de ce minéral,... -
EAU - Approvisionnement et traitement
- Écrit par Georges BREBION , Cyrille GOMELLA et Bernard LEGUBE
- 10 058 mots
- 5 médias
Le fer et lemanganèse sont présents sous forme dissoute (réduite) dans les eaux souterraines, eaux qui sont également appauvries en oxygène et riches en anhydride carbonique. Il faut donc effectuer une aération. Pour cela, l'eau traverse un lit de percolation, constitué de matériaux naturels... - Afficher les 14 références
Voir aussi
- ENZYMES
- LIGNINE
- HYDROSPHÈRE
- CATALASE
- FERROMANGANÈSE
- SILICOMANGANÈSE
- MANGANATES
- MANGANÈSE-PEROXYDASE
- POTENTIEL D'OXYDORÉDUCTION
- EXTRACTION, métallurgie
- BIOXYDE DE MANGANÈSE
- LECLANCHÉ PILE
- ACIER, technologie
- FERRO-ALLIAGES
- HYPOMANGANATES
- DOSAGE, chimie
- LIGAND ou COORDINAT, chimie
- DEGRÉ D'OXYDATION
- OXYDATION
- OXYDANTS
- PILES & ACCUMULATEURS
- SITE ACTIF, biochimie
- PERMANGANATES
- TRANSITION MÉTAUX DE
- RÉDUCTION, chimie
- OXYDORÉDUCTIONS, biologie
- NODULES POLYMÉTALLIQUES
- SUPEROXYDE DISMUTASE
- OXYDES
- PEROXYDASES
- JAHN-TELLER EFFET
- CYCLE GÉOCHIMIQUE
- HYDROTHERMALISME OCÉANIQUE ET SOURCES HYDROTHERMALES SOUS-MARINES
- PERMANGANATE DE POTASSIUM
- COORDINATION COMPOSÉS DE