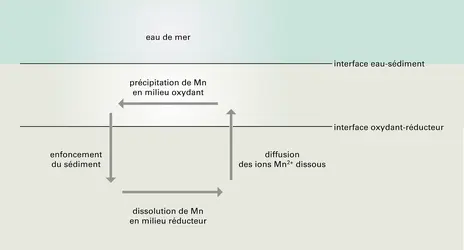
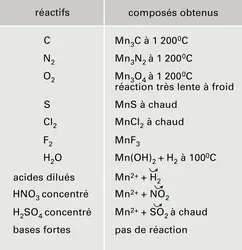
MANGANÈSE
Le manganèse dans les systèmes biologiques
Pour un grand nombre d'organismes, le manganèse est un nutriment essentiel. Chez l'homme, il est présent en faible quantité par comparaison au fer ou au zinc (de 12 à 20 mg chez un homme de 70 kg, à comparer aux 4 g de fer et aux 3 g de zinc) mais il intervient dans des processus métaboliques très variés, qui ne sont pas tous encore clairement identifiés. On sait qu'il est associé à la formation des tissus conjonctif et osseux, au développement embryonnaire de l'oreille interne, à la croissance, au métabolisme des glucides et des lipides, à la fonction de reproduction et au fonctionnement cérébral. Il est aussi présent chez les végétaux et les micro-organismes, pour lesquels ses rôles sont mieux connus que chez l'homme : la plupart des protéines à manganèse qui ont été étudiées sont issues de ces espèces.
Dans les systèmes biologiques, on rencontre le manganèse uniquement aux degrés d'oxydation II, III et IV. Comme pour beaucoup de métaux de transition, l'existence de plusieurs états rédox accessibles lui permet d'assurer des fonctions oxydoréductrices (transfert électronique).
Voici quelques systèmes enzymatiques mettant en jeu le manganèse :
– La manganèse-peroxydase. C'est une enzyme dont l'activité biologique consiste à dépolymériser par voie oxydante la lignine, polymère structurant du bois protégeant la cellulose contre les agressions extérieures de nature diverse. Cette enzyme possède à son actif un Mn(II) qui est, au cours du cycle catalytique, oxydé en Mn(III). Le site du Mn(II) est enfoui au cœur de la protéine. Or le substrat polymérique qu'est la lignine ne peut, en raison de sa taille, accéder à ce site pour y être oxydé. Nous avons vu (ci-dessus) que les géométries préférentielles pour les complexes du manganèse aux degrés d'oxydation II et III sont différentes, et les réactions de dioxydoréduction s'accompagnent en général de réarrangements drastiques de la sphère de coordination. Il est probable que le site à manganèse soit plus adapté à la stabilisation du Mn(II) que du Mn(III). En effet, on a montré que le Mn(III) se détache de la protéine et diffuse à l'extérieur jusqu'au cœur de la matrice polymérique de la lignine, où il joue son rôle d'oxydant. Le manganèse sert donc ici de navette en exportant les équivalents d'oxydant depuis le site actif jusqu'au substrat.
– Le système de dégagement du dioxygène chez les plantes. Les plantes utilisent la lumière solaire pour oxyder l'eau en dioxygène. C'est la photosynthèse. Ce processus complexe, qui correspond à une oxydation tétra-électronique (voir ci-dessous), a lieu au sein du photosystème II au niveau d'un cluster à quatre manganèses. Ce cluster, en utilisant différents degrés d'oxydation du manganèse (II, III et IV), accumule de manière séquentielle quatre lacunes électroniques. Il capte ensuite simultanément quatre électrons pour oxyder H2O en O2 : 2H2O → O2 + 4H+ + 4e— (lumière).
Parmi les différents états d'oxydation du cluster, il en existe un, dit S2, qui possède une signature en résonance paramagnétique électronique caractérisée par un signal remarquable comportant seize lignes.
Des hypothèses variées ont été faites pour la structure du site à quatre manganèses. Afin de tester ces hypothèses, les chimistes inorganiciens synthétisent des complexes dont la structure se rapproche le plus possible de celle postulée pour le cluster naturel. Le complexe [Mn(IV)4Mn(III)O6(2,2'-bipyridine)6]3+ a été décrit en 1997, conjointement par une équipe de l'université d'Orsay (le L.C.I.) et une équipe de l'université de Lund (Suède). Il présente un spectre de résonance paramagnétique très proche de celui de l'état S2.
Il existe d'autres[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bernard DUBOIS : professeur à l'École nationale supérieure de chimie de Paris et à l'université de Paris-VI
- Jacques FAUCHERRE : ancien directeur du laboratoire de chimie minérale de l'université de Paris-VII, professeur honoraire de chimie
- Gil MICHARD : docteur ès sciences, professeur à l'université de Paris-VII
- Clotilde POLICAR : professeur agrégée de sciences physiques, maître de conférences à l'université de Paris-XI
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
Classification
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER , Gérard FESSIER , Guy HENRY et Joëlle PONTET
- 14 178 mots
- 10 médias
Lemanganèse intervient également dans tous les aciers comme désoxydant. Dans les aciers alliés, il se comporte, dans un certain sens, comme le nickel ; il augmente la trempabilité, permet d'obtenir des aciers à structure austénitique stable. Mais il participe à la formation de carbures et se trouve... -
AIMANTS
- Écrit par Roger FONTAINE
- 6 274 mots
- 13 médias
Un autre exemple de matériau à réaction désordre-ordre se trouve, pour certaines compositions, dans les alliages manganèse-aluminium. Ainsi, l'alliage de composition 72 p. 100 Mn, 28 p. 100 Al à structure hexagonale à haute température se transforme à 700 0C en une phase tétragonale... -
CARBONATES
- Écrit par Marc DARDENNE et André JAUZEIN
- 5 052 mots
- 12 médias
Ce minéral a aussi été appelé « dialogite » à cause de l'incertitude qui régnait à l'origine sur sa composition.La substitution du fer ferreux ou du calcium au manganèse est la plus fréquente. Lorsqu'elle existe, la couleur rose (en grec, rhodochros) est caractéristique de ce minéral,... -
EAU - Approvisionnement et traitement
- Écrit par Georges BREBION , Cyrille GOMELLA et Bernard LEGUBE
- 10 058 mots
- 5 médias
Le fer et lemanganèse sont présents sous forme dissoute (réduite) dans les eaux souterraines, eaux qui sont également appauvries en oxygène et riches en anhydride carbonique. Il faut donc effectuer une aération. Pour cela, l'eau traverse un lit de percolation, constitué de matériaux naturels... - Afficher les 14 références