MATIÈRE (physique) État gazeux
Article modifié le
Les gaz parfaits en équilibre thermodynamique
Lorsqu'on enferme une certaine quantité de gaz dans une enceinte maintenue à une température constante T, il s'établit au bout d'un certain temps un équilibre thermodynamique entre le gaz et l'enceinte. Cet équilibre constitue un état stationnaire, c'est-à-dire indépendant du temps, caractérisé par une équation d'état f(P, V, T) = 0, relation entre les trois variables d'état : pression P, volume V et température T.
Description microscopique
Dans le modèle cinétique le plus simple, les molécules d'un gaz sont considérées comme des sphères rigides élastiques animées de mouvements désordonnés, sans autres interactions que les collisions élastiques qu'elles subissent entre elles ainsi que sur les parois du récipient qui contient le gaz. Au cours de ces collisions, l'énergie cinétique et la quantité de mouvement sont conservées. Lorsque la pression décroît, la fréquence des collisions diminue et le libre parcours (distance parcourue entre deux collisions successives) devient très grand par rapport à la taille moléculaire. À la limite de la pression nulle, le gaz parfait est constitué de molécules quasi ponctuelles sans aucune interaction.
La théorie cinétique des gaz, fondée sur la mécanique statistique de Boltzmann, permet de déterminer la loi de répartition des vitesses. Celle-ci repose sur l'hypothèse que la distribution des vitesses est isotrope et que la distribution de chacune des composantes du vecteur vitesse v est indépendante de celle des deux autres. La densité de probabilité f(v) pour qu'une molécule de masse m possède l'énergie cinétique Ec = 1/2 (m|v|2) est égale au produit d'une fonction exponentiellement décroissante de Ec par un facteur de normalisation :

La fraction de molécules possédant une vitesse dont le module est compris entre v et v + dv vaut : F(v) dv = 4π v2f(v) dv.
La fonction F(v) représentée sur la figure 2 caractérise la distribution de Maxwell des vitesses.
On déduit de l'expression de F(v) :
– la vitesse la plus probable v* (dF/dv = 0) :
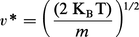
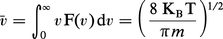
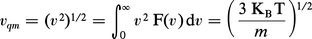
Ces trois vitesses sont proportionnelles à (KBT / m)1/2. La vitesse moléculaire est donc une fonction croissante de la température. À la même température, les molécules plus lourdes se déplacent plus lentement que les molécules légères. Par exemple, pour le diazote N2 à température ambiante (T = 300 K) vqm ≈ 500 ms—1, valeur comparable à la vitesse du son dans le gaz.
Équation d'état des gaz parfaits
La pression du gaz résulte des chocs moléculaires sur les parois. Bien que pour des surfaces de dimensions comparables aux distances intermoléculaires cette pression soit extrêmement variable, elle peut être considérée comme constante lorsqu'on considère un élément de surface macroscopique. La pression (&Pmacron ;) exercée par les molécules animées d'une vitesse v est égale au produit de la quantité de mouvement (mv) cédée à la paroi par les molécules par le nombre effectif de chocs et par unité de temps et de surface :

La valeur moyenne de la pression (p̄) vaut donc :
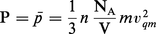
Dans le système international, la pression s'exprime en pascals (Pa), le volume en mètres cubes (m[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Henri DUBOST : docteur ès sciences, directeur de recherche au C.N.R.S.
- Jean-Marie FLAUD : docteur ès sciences, directeur de recherche au C.N.R.S.
Classification
Médias
Autres références
-
ÉTAT DE LA MATIÈRE, notion d'
- Écrit par Bernard PIRE
- 1 521 mots
L'expérience quotidienne permet à chacun d'appréhender la notion d'état de la matière (parfois appelé phase) et celle de transition de phase qui lui est étroitement liée. L'exemple typique est celui des trois états si différents que prend l'eau lorsque sa température varie : à partir de 0 ...
-
MATIÈRE, notion de
- Écrit par Jean-Marc LÉVY-LEBLOND
- 2 022 mots
Le mot « matière » cache sous sa généralité abstraite une origine concrète fort éclairante. En latin archaïque, materia appartient à la langue rustique et désigne la substance dont est fait le tronc de l'arbre, en tant qu'elle est productrice (de branches, de feuilles). L'élargissement successif...
-
ANTIMATIÈRE
- Écrit par Bernard PIRE et Jean-Marc RICHARD
- 6 934 mots
- 4 médias
...associé est bâti avec les antiquarks correspondants. Les mésons résultent de la liaison d'un quark et d'un antiquark. Dans cette description moderne, la matière est constituée par trois « générations » de quarks et de leptons, le nombre trois a été établi par les expériences du C.E.R.N. (laboratoire européen... -
ATOME
- Écrit par José LEITE LOPES
- 9 146 mots
- 13 médias
L'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné. On connaît 90 éléments naturels auxquels s'ajoutent le ...
-
BOHR ATOME DE
- Écrit par Bernard PIRE
- 369 mots
- 1 média
Deux ans après avoir soutenu sa thèse sur la théorie électronique des métaux, le physicien danois Niels Bohr (1885-1962) écrit en 1913 trois articles fondamentaux qui révolutionnent la compréhension de la structure de la matière. Le premier, paru le 5 avril dans le Philosophical Magazine...
-
ATOME, notion d'
- Écrit par Bernard PIRE
- 1 499 mots
« Brique insécable » de la matière selon son étymologie, l'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné, les corps simples étant...
- Afficher les 40 références
Voir aussi
- ONDE ou RAYONNEMENT ÉLECTROMAGNÉTIQUE
- GAZ DIATOMIQUES
- GAZ POLYATOMIQUES
- ABSORPTION, physique
- PRESSION, physique
- POLARISABILITÉ MOLÉCULAIRE
- UNITÉS SYSTÈMES D'
- ÉTATS DE LA MATIÈRE
- LIBRE PARCOURS MOYEN
- POTENTIEL INTERMOLÉCULAIRE
- INTERACTIONS MOLÉCULAIRES
- ISOBARE
- PHASE TRANSITIONS DE
- VITESSE
- ÉTAT CHANGEMENT D'
- COLLISION, physique
- COLLISIONS ÉLASTIQUES
- ÉQUILIBRE THERMODYNAMIQUE
- MOLÉCULES DIATOMIQUES
- DIFFUSION
- ÉTAT ÉQUATION D'
- ÉNERGIE INTERNE
- DIAGRAMME, thermodynamique
- POINT CRITIQUE
- EXCITATION ÉLECTRONIQUE ÉNERGIE D'
- CHARLES LOI DE
- COMPRESSIBILITÉ ISOTHERME COEFFICIENT DE
- CLAPEYRON DIAGRAMME DE
- FUSION
- MAXWELL-BOLTZMANN DISTRIBUTION DE
- GAZ MONOATOMIQUES
- GAZ RÉELS
- GAZ PARFAITS LOI DES
- LOSCHMIDT NOMBRE DE
- GAY-LUSSAC LOI DE
- ISOTHERME
- VAN DER WAALS ÉQUATION DE
- POLAIRES MOLÉCULES
- TRANSMISSION, optique
- VAPORISATION
- SUBLIMATION, thermodynamique
- POINT TRIPLE, thermodynamique
- MOLÉCULES POLYATOMIQUES
- THERMIQUE AGITATION
- ROTATION MOLÉCULAIRE ÉNERGIE DE
- VIBRATION MOLÉCULAIRE ÉNERGIE DE
- VARIABLES D'ÉTAT
- BEER-LAMBERT LOI DE
- TRANSITION, physique
- ÉNERGIE POTENTIELLE
- PASCAL, unité
- ÉPAISSEUR OPTIQUE
- ENTHALPIE
- GAZEUX ÉTAT
- FONCTION D'ÉTAT, thermodynamique
- TRAVAIL, physique
- TEMPÉRATURE
- BOLTZMANN CONSTANTE DE
- PARTITION FONCTION DE
- ÉNERGIE LIBRE DE HELMHOLTZ
- NIVEAU, physique atomique
- ISOCHORE
- JOULE LOIS DE, thermodynamique
- BOYLE-MARIOTTE LOI DE
- ADIABATIQUE TRANSFORMATION
- CAPACITÉ CALORIFIQUE
- AMAGAT DIAGRAMME D'
- LONDON FORCES DE
- VIRIEL ÉQUATION DU
- ÉNERGIE CINÉTIQUE
- DISTRIBUTION DE CHARGE
- PHASES, physico-chimie
- TEMPÉRATURE CRITIQUE
- TRANSPORT ÉQUATION DE
- TRANSFORMATIONS THERMODYNAMIQUES
- AVOGADRO NOMBRE D'
- RAIE SPECTRALE
- SPECTRE D'ABSORPTION
- MOMENT ÉLECTRIQUE
- COEFFICIENT DE DIFFUSION
- CONDUCTION THERMIQUE
- TORR ou MILLIMÈTRE DE MERCURE, unité