MATIÈRE (physique) État liquide
Article modifié le
La structure des liquides à l'échelle moléculaire
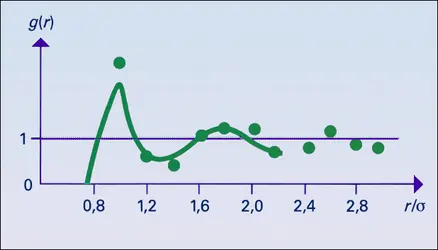
La fonction de distribution de paire
La diffusion des rayonnements de courte longueur d'onde, rayons X ou neutrons, révèle que les liquides se caractérisent par un certain ordre à courte distance mais sont désordonnés à longue distance. Dans le cas d'un liquide formé de particules sphériques (atomes, molécules), la seule variable géométrique servant à décrire le système est la distance r entre les centres des particules. La structure du liquide est décrite par une fonction de distribution de paire g(r) qui permet de définir la probabilité de trouver une deuxième particule à une distance r de la première. Ainsi, si l'on prend comme origine le centre d'une particule et que l'on considère deux sphères de rayons r et r + dr centrées en ce point, le nombre moyen de particules ayant leur centre entre ces deux sphères est de :

La fonction de distribution de paire est obtenue expérimentalement à partir de l'analyse de la variation angulaire de l'intensité de rayons X diffusée. Elle permet le calcul de nombreuses propriétés du liquide. On peut en particulier démontrer que la compressibilité isotherme χT obéit à l'équation :

Les potentiels intermoléculaires et les modèles de l'état liquide
Pour comprendre théoriquement l'état liquide, il convient d'avoir en mémoire qu'il existe toujours entre deux molécules neutres des forces présentant un caractère attractif à courte distance, que l'on nomme forces de Van der Waals. Elles se manifestent par un minimum de la courbe de variation de l'énergie d'interaction u(r) avec la distance. Dans le cas le plus simple, celui de deux atomes de gaz rare, l'énergie d'interaction ne dépend que de la distance, et sa variation est donnée par l'équation empirique de Lennard-Jones (fig. 3a). Pour des systèmes plus complexes, d'autres phénomènes peuvent venir s'ajouter aux précédents pour modifier fortement la forme de la courbe u(r) (fig. 3b). On retrouve cependant le minimum très marqué aux courtes distances interatomiques.
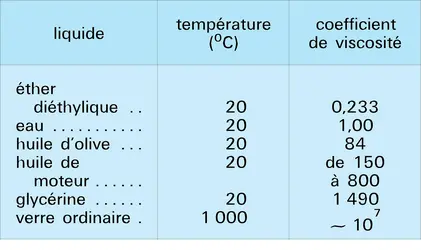
L'énergie d'interaction qui existe entre les particules d'un liquide permet d'en comprendre qualitativement les propriétés. Tout d'abord, elle explique la présence des phases liquide et solide à des températures même proche du zéro absolu où, en l'absence de cette énergie, l'agitation thermique serait suffisante pour donner immédiatement l'état gazeux. Elle permet également de comprendre le phénomène de tension superficielle des liquides. En effet, l'énergie d'interaction conduit chaque molécule à chercher à s'entourer du plus grand nombre de voisines, le liquide a donc tendance à présenter la surface libre le plus petite possible.
Du point de vue quantitatif, si l'on suppose que l'énergie d'interaction de n molécules peut se décomposer en une somme des énergies d'interaction de paire (ce[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Louis RIVAIL : professeur de chimie théorique à l'université de Nancy-I
Classification
Médias
Autres références
-
ÉTAT DE LA MATIÈRE, notion d'
- Écrit par Bernard PIRE
- 1 521 mots
L'expérience quotidienne permet à chacun d'appréhender la notion d'état de la matière (parfois appelé phase) et celle de transition de phase qui lui est étroitement liée. L'exemple typique est celui des trois états si différents que prend l'eau lorsque sa température varie : à partir de 0 ...
-
MATIÈRE, notion de
- Écrit par Jean-Marc LÉVY-LEBLOND
- 2 022 mots
Le mot « matière » cache sous sa généralité abstraite une origine concrète fort éclairante. En latin archaïque, materia appartient à la langue rustique et désigne la substance dont est fait le tronc de l'arbre, en tant qu'elle est productrice (de branches, de feuilles). L'élargissement successif...
-
ANTIMATIÈRE
- Écrit par Bernard PIRE et Jean-Marc RICHARD
- 6 934 mots
- 4 médias
...associé est bâti avec les antiquarks correspondants. Les mésons résultent de la liaison d'un quark et d'un antiquark. Dans cette description moderne, la matière est constituée par trois « générations » de quarks et de leptons, le nombre trois a été établi par les expériences du C.E.R.N. (laboratoire européen... -
ATOME
- Écrit par José LEITE LOPES
- 9 146 mots
- 13 médias
L'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné. On connaît 90 éléments naturels auxquels s'ajoutent le ...
-
BOHR ATOME DE
- Écrit par Bernard PIRE
- 369 mots
- 1 média
Deux ans après avoir soutenu sa thèse sur la théorie électronique des métaux, le physicien danois Niels Bohr (1885-1962) écrit en 1913 trois articles fondamentaux qui révolutionnent la compréhension de la structure de la matière. Le premier, paru le 5 avril dans le Philosophical Magazine...
-
ATOME, notion d'
- Écrit par Bernard PIRE
- 1 499 mots
« Brique insécable » de la matière selon son étymologie, l'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné, les corps simples étant...
- Afficher les 40 références
Voir aussi
- HYDROGÈNE LIAISON
- LIQUIDE ÉTAT
- ÉTATS DE LA MATIÈRE
- POTENTIEL INTERMOLÉCULAIRE
- INTERACTIONS MOLÉCULAIRES
- EAU, physico-chimie
- PHASE TRANSITIONS DE
- ÉTAT CHANGEMENT D'
- ÉCOULEMENTS
- ÉNERGIE INTERNE
- DIAGRAMME, thermodynamique
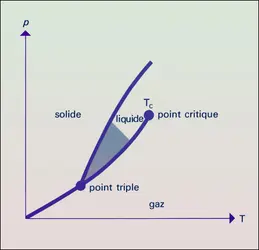
- POINT CRITIQUE
- FUSION
- VAPORISATION
- POINT TRIPLE, thermodynamique
- LAMINAIRE ÉCOULEMENT
- LUBRIFICATION
- TENSION SUPERFICIELLE
- CAPILLARITÉ
- POISEUILLE LOI DE
- ÉBULLITION
- FONCTION DE DISTRIBUTION DE PAIRE
- TEMPÉRATURE CRITIQUE
- TEMPÉRATURE DE TRANSITION
- LENNARD-JONES POTENTIEL DE