MATIÈRE (physique) Transitions de phase
Transitions sans paramètre d'ordre
Les transitions sans paramètre d'ordre, comme toutes celles du premier ordre, sont caractérisées par le fait qu'au point de transition les deux phases en présence sont en équilibre.
Changements d'état
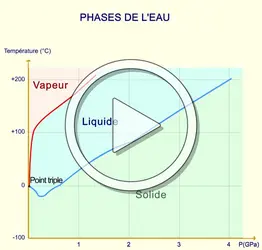
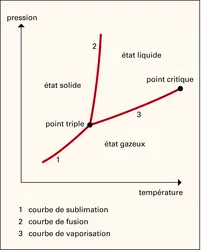
Les transitions sont souvent sensibles à diverses actions extérieures. La température de vaporisation, par exemple, est sensible à la pression. Dans un diagramme (p, T), le lieu des points de transition liquide-gaz constitue la courbe de vaporisation. Dans le même diagramme, on définit de façon analogue la courbe de fusion et de sublimation. Ces trois courbes ont un point commun, le point triple, pour lequel les trois phases (solide, liquide et gazeuse) sont en équilibre. Pour toutes les transitions du premier ordre, il est possible de déterminer une chaleur latente de transformation. Dans le cas de la fusion, de la vaporisation ou de la sublimation, la chaleur latente L est liée à la variation du volume spécifique ΔV lors du passage d'une phase à l'autre, et à la pente dp/dT de la ligne de transition par la formule de Clapeyron :

Cette formule a de très nombreuses applications, dont celle de prévoir dans quel sens varie la température de fusion avec la pression. La fusion s'accompagne toujours d'une absorption de chaleur ; en outre, dans la plupart des cas, le solide a un volume spécifique plus faible que le liquide : il s'ensuit que dp/dT est positif, et la température de fusion augmente avec la pression. Le cas de l'eau est particulier, car, la glace étant moins dense qu'elle, la température de fusion diminue quand la pression augmente. La formule de Clapeyron permet aussi d'estimer approximativement la pente de la courbe de vaporisation si l'on suppose négligeable le volume spécifique du liquide en comparaison de celui de la vapeur et si on assimile la vapeur à un gaz parfait. Pour une mole, on remplace donc ΔV par RT/p et l'on obtient :

On a réussi à suivre des courbes de fusion jusqu'à des pressions de l'ordre de 3 × 109 Pa et jusqu'à des températures de quelques centaines de degrés. Ces expériences ont révélé que la courbe de fusion semble se prolonger indéfiniment, contrairement à la courbe de vaporisation qui est limitée par le point critique (fig. 1). Si l'on peut passer continûment de l'état gazeux à l'état liquide, il est impossible de passer sans discontinuité de l'état liquide à l'état solide. L'état gazeux et l'état liquide sont qualitativement identiques, car ils sont tous deux isotropes, tandis que l'état solide cristallisé est anisotrope.
Polymorphisme cristallin
Les transitions entre variétés cristallines différentes d'un même corps pur sont, elles aussi, des transitions sans paramètre d'ordre. À une température et à une pression déterminées, la phase la plus stable est celle dont le potentiel thermodynamique est le plus bas. La variation de volume qui accompagne une transition entre deux formes cristallines différentes étant, en général, très faible, on peut la négliger et discuter la stabilité des diverses phases à l'aide de l'énergie libre F. Les exemples de polymorphisme sont très nombreux. Plus de la moitié des corps simples possèdent cette propriété. Les cristaux de soufre, obtenus à froid par évaporation d'une solution dans le sulfure de carbone, sont orthorhombiques, tandis que ceux qui se forment par refroidissement du soufre liquide sont monocliniques. L'étain blanc quadratique, stable au-dessus de 18 0C, se transforme au contact d'un germe[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Nino BOCCARA : directeur de recherche au C.N.R.S., professeur à l'École supérieure de physique et de chimie industrielles de Paris, professeur à l'université de l'Illinois à Chicago
Classification
Médias
Autres références
-
ÉTAT DE LA MATIÈRE, notion d'
- Écrit par Bernard PIRE
- 1 521 mots
L'expérience quotidienne permet à chacun d'appréhender la notion d'état de la matière (parfois appelé phase) et celle de transition de phase qui lui est étroitement liée. L'exemple typique est celui des trois états si différents que prend l'eau lorsque sa température varie : à partir de 0 ...
-
MATIÈRE, notion de
- Écrit par Jean-Marc LÉVY-LEBLOND
- 2 022 mots
Le mot « matière » cache sous sa généralité abstraite une origine concrète fort éclairante. En latin archaïque, materia appartient à la langue rustique et désigne la substance dont est fait le tronc de l'arbre, en tant qu'elle est productrice (de branches, de feuilles). L'élargissement successif...
-
ANTIMATIÈRE
- Écrit par Bernard PIRE et Jean-Marc RICHARD
- 6 934 mots
- 4 médias
...associé est bâti avec les antiquarks correspondants. Les mésons résultent de la liaison d'un quark et d'un antiquark. Dans cette description moderne, la matière est constituée par trois « générations » de quarks et de leptons, le nombre trois a été établi par les expériences du C.E.R.N. (laboratoire européen... -
ATOME
- Écrit par José LEITE LOPES
- 9 146 mots
- 13 médias
L'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné. On connaît 90 éléments naturels auxquels s'ajoutent le ...
-
BOHR ATOME DE
- Écrit par Bernard PIRE
- 369 mots
- 1 média
Deux ans après avoir soutenu sa thèse sur la théorie électronique des métaux, le physicien danois Niels Bohr (1885-1962) écrit en 1913 trois articles fondamentaux qui révolutionnent la compréhension de la structure de la matière. Le premier, paru le 5 avril dans le Philosophical Magazine...
-
ATOME, notion d'
- Écrit par Bernard PIRE
- 1 499 mots
« Brique insécable » de la matière selon son étymologie, l'atome est le terme ultime de la division de la matière dans lequel les éléments chimiques conservent leur individualité. C'est la plus petite particule d'un élément qui existe à l'état libre ou combiné, les corps simples étant...
- Afficher les 40 références