MATRICE INTERCELLULAIRE ou MATRICE EXTRACELLULAIRE
Article modifié le
La matrice intercellulaire est une substance qui se trouve chez les animaux pluricellulaires dans les espaces intercellulaires, et les tissus riches en matrice ont été désignés comme « tissus conjonctifs ». Cette matrice est composée de quatre familles de macromolécules, les collagènes et l' élastine formant une trame de protéines fibreuses, dont les interstices sont remplis par les protéoglycannes ; enfin, les glycoprotéines de structure assurent la cohésion entre cellules et matrice.
Il est aujourd'hui démontré que tous les tissus contiennent de la matrice intercellulaire en quantité variable, et on réalise que la transition entre les tissus parenchymateux, tel le foie, par exemple, et les tissus appelés classiquement « conjonctifs », comme une lame tendineuse, n'est que quantitative. Il n'y a pas de différence qualitative essentielle entre les tissus car, bien que la qualité et la quantité des macromolécules de la matrice intercellulaire varient, leur présence est constante dans tous les tissus.
La matrice intercellulaire joue un rôle important dans l'histogenèse, la différenciation et la morphogenèse. Ses modifications qualitatives et quantitatives sont en cause dans de nombreux états pathologiques (voir collagène, élastine).
Les protéoglycannes
Les protéoglycannes et la matrice intercellulaire étaient primitivement connus en tant que mucopolysaccharides acides, car c'est leur partie glycosaminoglycannique qui a été d'abord isolée et caractérisée. On ne devait reconnaître que beaucoup plus tard qu'il s'agissait en fait de produits de dégradation de protéoglycannes qui, depuis, ont été isolés à l'état natif et étudiés.
Composition
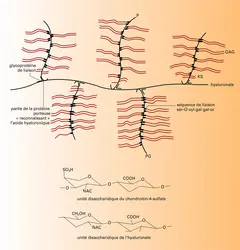
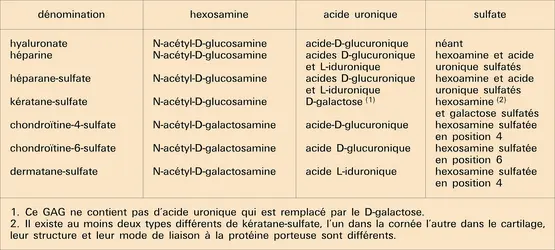
Les protéoglycannes sont caractérisés par leur richesse en glucides. Les chaînes glycosaminoglycanniques sont constituées par la polymérisation d'unités répétitives comportant le plus souvent une molécule d'hexosamine et une molécule d' acide uronique ; ces deux constituants peuvent être sulfatés ou non, et ces disaccharides sont répétés un grand nombre de fois pour constituer des chaînes glucidiques de poids moléculaire variant de 10 000 à 50 000 environ. Une exception est le kératane-sulfate qui, à la place de l'acide uronique, comporte du galactose. Ces longues chaînes glycosaminoglycanniques sont fixées sur une protéine porteuse centrale comme les poils d'un goupillon, avec une séquence intermédiaire qui est identique pour de nombreux glycosaminoglycannes, et qui comporte, après l'acide uronique terminal, deux résidus de galactose et un résidu de xylose lié par une liaison O-glycosidique sur une sérine ou thréonine de la protéine porteuse. La protéine porteuse a une composition caractéristique dans la mesure où elle est riche en proline, glycine, sérine et thréonine. Elle comporte deux parties essentiellement distinctes : l'une qui fixe les glycosaminoglycannes et l'autre, exempte de glucides, qui forme un site de reconnaissance pour l' acide hyaluronique.
L'acide hyaluronique est un glycosaminoglycanne spécial dans la mesure où il ne paraît pas être lié à une protéine porteuse et où son poids moléculaire est très supérieur à celui des autres glycosaminoglycannes (de 1 à 10 fois 106). L'acide hyaluronique peut donc fixer de nombreuses unités protéo-glycanniques formant des agrégats de taille moléculaire de plusieurs centaines de millions. Ces agrégats sont stabilisés par la spécificité de la reconnaissance entre l'acide hyaluronique et la protéine porteuse. Cette reconnaissance est de surcroît renforcée par des glycoprotéines de liaison (link-glycoproteins) qui se fixent à l'interface entre protéine porteuse et hyaluronate et confèrent ainsi une grande stabilité à ces énormes agrégats qui remplissent les interstices entre les fibres de collagène[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacqueline LABAT-ROBERT : chargée de recherche au C.N.R.S., docteur en pharmacie
- Ladislas ROBERT : directeur de recherche au C.N.R.S., docteur en médecine, docteur ès sciences, directeur de laboratoire de biochimie du tissu conjonctif à la faculté de médecine, université de Paris-Val-de-Marne.
Classification
Médias
Autres références
-
ARTICULATIONS
- Écrit par Claude GILLOT et André-Paul PELTIER
- 6 074 mots
- 4 médias
...conjonctif les plus simples de l'organisme puisqu'il comprend seulement des cellules dites chondrocytes en concentration relativement faible et un matériel intercellulaire appelé substance fondamentale. Dans le cartilage de l'animal adulte, il n'y a ni vaisseaux, ni lymphatiques, ni nerfs. Le cartilage dépend... -
CARTILAGE
- Écrit par Didier LAVERGNE
- 397 mots
Tissu de soutien d'origine mésenchymateuse dont la différenciation dépend étroitement de la mise en jeu de facteurs mécaniques (pressions et frottements), le cartilage comprend des cellules appelées chondrocytes, de forme arrondie. Leur multiplication par mitose correspond à la croissance interstitielle...
-
CONNECTIVITES
- Écrit par Ladislas ROBERT
- 1 760 mots
On désigne par le terme connectivite ou collagénose un ensemble de maladies ou de syndromes qui touchent plus particulièrement certains tissus riches en matrice intercellulaire (tissus conjonctifs). Le terme connectivite évoque un processus inflammatoire (...ite) touchant des tissus conjonctifs...
-
ÉLASTINE
- Écrit par William HORNEBECK et Ladislas ROBERT
- 1 941 mots
- 2 médias
Un tissu animal élastique est défini comme un tissu riche en élastine, possédant de ce fait des propriétés physiques similaires à celles du caoutchouc. Le ligament large de la nuque des ongulés et leurs cordes vocales, l'aorte et les artères pulmonaires de tous les primates sont considérés comme...
Voir aussi
- MUCOPOLYSACCHARIDES
- HYALURONIQUE ACIDE
- HISTOLOGIE ANIMALE
- HÉPARINE
- MUCOPOLYSACCHARIDOSES
- MÉTABOLIQUES MALADIES
- POLYSACCHARIDES ou POLYHOLOSIDES
- ENZYMOPATHIES
- GLYCOPROTÉINES
- PROTÉOGLYCANES
- CHONDRONECTINE
- FIBRONECTINE
- GLYCOSAMINOGLYCANES (GAG)
- LAMININE
- URONIQUE ACIDE
- MACROMOLÉCULES BIOLOGIQUES
- LDL (low density lipoproteins)