MATRICE INTERCELLULAIRE ou MATRICE EXTRACELLULAIRE
Article modifié le
Les glycoprotéines de structure
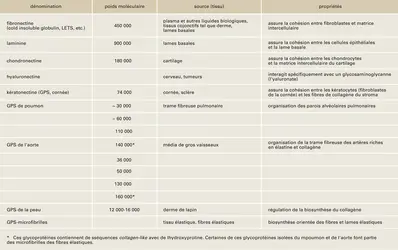
Des quatre familles de macromolécules, collagènes, élastine, protéoglycannes et glycoprotéines de structure, ce sont ces dernières qui ont été le plus tardivement caractérisées. Cela pour deux raisons : difficulté de leur isolement, absence de constituants caractéristiques. La première glycoprotéine de structure a été isolée à partir du stroma de la cornée, en 1960, par L. Robert : c'est la kératonectine. Depuis une dizaine d'années, de nombreux autres composants appartenant à cette même classe ont été isolés et caractérisés à partir d'un grand nombre de tissus conjonctifs d'Invertébrés et de Vertébrés : fibronectine, laminine, chondronectine, hyaluronectine, entactine. Les mieux étudiés sont certainement la fibronectine et la laminine.
Localisation
La fibronectine est élaborée surtout par les cellules mésenchymateuses, telles que fibroblastes, cellules musculaires lisses, et se rencontre in vivo essentiellement à deux niveaux, sous forme soluble dans le plasma où sa concentration augmente avec l'âge, ainsi que dans divers liquides biologiques, sous forme insoluble associée à de nombreuses membranes basales, et dans les tissus conjonctifs lâches.
Laminine et entactine sont des glycoprotéines de structure spécifiques des lames basales. La laminine a été mise en évidence en microscopie électronique au niveau des laminae rarae épithéliales et glomérulaires. L'hyaluronectine a été décrite par B. Delpech et d'autres chercheurs au niveau du système nerveux central et dans d'autres tissus également. La chondronectine existe à la surface des cellules cartilagineuses. Plusieurs autres glycoprotéines de structure ont été isolées et caractérisées, mais elles n'ont pas reçu de dénomination spéciale (L. Robert, S. Junqua et M. Moczar).
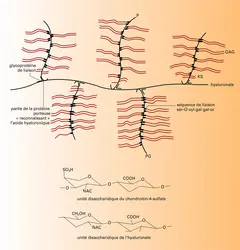
Ces glycoprotéines de structure sont présentes au niveau cellulaire, à l'intérieur des cellules et à leur surface, et dans la matrice intercellulaire. Elles peuvent s'associer aux autres macromolécules de la matrice, et c'est pourquoi l'hypothèse de leur rôle possible dans la morphogenèse du tissu conjonctif, dans le positionnement des cellules au sein de cette matrice, fut formulée pour la première fois il y a une trentaine d'années. Certaines ont un rôle régulateur dans la synthèse du collagène.
Fonction mécanique
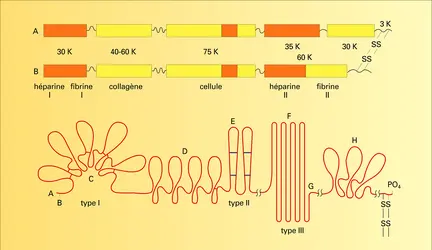
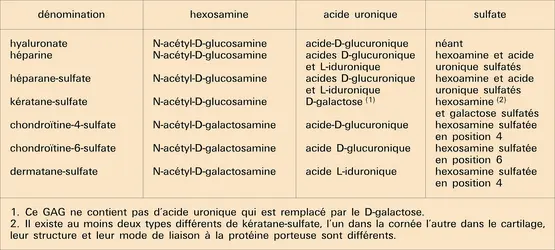
Les glycoprotéines de structure présentent d'intéressantes propriétés qui conditionnent leurs possibles fonctions. Elles interagissent avec les collagènes, surtout interstitiels pour la fibronectine, types IV et V pour la laminine, type II pour la chondronectine, avec les protéoglycannes, particulièrement avec leur « moitié » glycosaminoglycannique. Ces interactions ont été particulièrement étudiées pour la fibronectine qui, en outre, interagit avec certains éléments du cytosquelette (actine, vinculine), avec l'ADN, avec certains types cellulaires, avec des bactéries... Toutes ces interactions sont spécifiques, « médiées » par des sites qui ont pu être localisés sur la molécule de fibronectine par protéolyse ménagée. Un des modèles de structure de la fibronectine fait l'objet de la figure.
Ces propriétés conditionnent les possibles fonctions de cette glycoprotéine de structure : rôle dans l'adhésion cellulaire, dans la morphogenèse du tissu conjonctif, dans les processus de cicatrisation. Elle présente également un caractère d'opsonine.
Laminine et chondronectine sont aussi considérées comme des protéines d'adhésion : la laminine jouerait un rôle important dans l'ancrage des cellules épithéliales sur la lame basale, par exemple dermo-épidermique, ou dans d'autres tissus comme la paroi intestinale, et la chondronectine interviendrait dans l'insertion des chondrocytes dans la trame fibreuse du cartilage, formé principalement de collagène de[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacqueline LABAT-ROBERT : chargée de recherche au C.N.R.S., docteur en pharmacie
- Ladislas ROBERT : directeur de recherche au C.N.R.S., docteur en médecine, docteur ès sciences, directeur de laboratoire de biochimie du tissu conjonctif à la faculté de médecine, université de Paris-Val-de-Marne.
Classification
Médias
Autres références
-
ARTICULATIONS
- Écrit par Claude GILLOT et André-Paul PELTIER
- 6 074 mots
- 4 médias
...conjonctif les plus simples de l'organisme puisqu'il comprend seulement des cellules dites chondrocytes en concentration relativement faible et un matériel intercellulaire appelé substance fondamentale. Dans le cartilage de l'animal adulte, il n'y a ni vaisseaux, ni lymphatiques, ni nerfs. Le cartilage dépend... -
CARTILAGE
- Écrit par Didier LAVERGNE
- 397 mots
Tissu de soutien d'origine mésenchymateuse dont la différenciation dépend étroitement de la mise en jeu de facteurs mécaniques (pressions et frottements), le cartilage comprend des cellules appelées chondrocytes, de forme arrondie. Leur multiplication par mitose correspond à la croissance interstitielle...
-
CONNECTIVITES
- Écrit par Ladislas ROBERT
- 1 760 mots
On désigne par le terme connectivite ou collagénose un ensemble de maladies ou de syndromes qui touchent plus particulièrement certains tissus riches en matrice intercellulaire (tissus conjonctifs). Le terme connectivite évoque un processus inflammatoire (...ite) touchant des tissus conjonctifs...
-
ÉLASTINE
- Écrit par William HORNEBECK et Ladislas ROBERT
- 1 941 mots
- 2 médias
Un tissu animal élastique est défini comme un tissu riche en élastine, possédant de ce fait des propriétés physiques similaires à celles du caoutchouc. Le ligament large de la nuque des ongulés et leurs cordes vocales, l'aorte et les artères pulmonaires de tous les primates sont considérés comme...
Voir aussi
- MUCOPOLYSACCHARIDES
- HYALURONIQUE ACIDE
- HISTOLOGIE ANIMALE
- HÉPARINE
- MUCOPOLYSACCHARIDOSES
- MÉTABOLIQUES MALADIES
- POLYSACCHARIDES ou POLYHOLOSIDES
- ENZYMOPATHIES
- GLYCOPROTÉINES
- PROTÉOGLYCANES
- CHONDRONECTINE
- FIBRONECTINE
- GLYCOSAMINOGLYCANES (GAG)
- LAMININE
- URONIQUE ACIDE
- MACROMOLÉCULES BIOLOGIQUES
- LDL (low density lipoproteins)