MEMBRANES, transferts
Article modifié le
Membranes denses
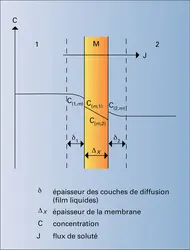
On appelle membranes denses des membranes qui n'ont plus aucune porosité libre. Elles sont gonflées par le solvant mais celui-ci, fortement lié chimiquement au matériau membranaire, a perdu toutes ses propriétés de solvatation ; le solvant traverse alors la membrane sans entraîner de soluté. Celle-ci se comporte comme un mélange hydro-organique ayant des propriétés de solvatation particulières ; le coefficient de partage entre la membrane et la solution dépend donc de la nature et de la composition chimique de la membrane. Mais, pour que le transfert d'eau puisse avoir lieu, il est nécessaire que celle-ci soit l'un des composants de la membrane ; une membrane dense qu'on laisse sécher perd ses propriétés osmotiques, souvent d'une façon irréversible.
Osmose
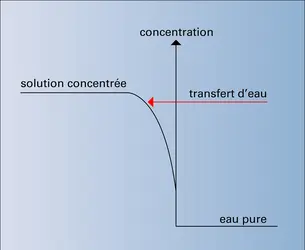
Le phénomène d'osmose est connu depuis le xviiie siècle. Les membranes denses utilisées sont perméables à l'eau, mais imperméables aux solutés. Si deux compartiments, l'un concentré, l'autre dilué, sont séparés par une telle membrane, l'équilibre des potentiels chimiques ne peut être obtenu que par transfert d'eau vers le milieu concentré, jusqu'à une différence de niveau telle que la différence de potentiel chimique due à la pression équilibre celle qui est due à la différence de concentration. On appelle alors cette valeur pression osmotique π. La valeur de cette pression osmotique peut être évaluée simplement en considérant que les particules libres dissoutes se comportent comme un gaz dans un volume donné qui serait ici celui du solvant. On écrit alors :


Pour exprimer la concentration en osmolarité, il faut tenir compte de la dissociation des molécules dissoutes qui peuvent donner naissance à plusieurs ions libres. Par exemple, une mole de chlorure de sodium dissociée en deux ions donnera naissance à deux osmoles. Dans le cas de molécules partiellement dissociées, il faut tenir compte du coefficient de dissociation.
En première approximation, il est possible de calculer simplement la pression osmotique d'une solution en considérant que, dans les conditions normales, le produit PV = 22,4. On aura alors : π = 22,4 C (π en atmosphères et C en osmolarité).
L'osmose est un phénomène important dans la nature ; c'est ainsi que les plantes (milieu concentré) absorbent l'eau à partir du sol (milieu dilué). Un arrosage à l'eau de mer, ou un excès d'engrais, peut inverser le rapport des concentrations et, par voie de conséquence, le phénomène d'osmose ; cela se traduit alors par un dessèchement de la plante. Cependant, certaines plantes à très forte pression osmotique interne peuvent subsister en bord de mer.
Osmose inverse
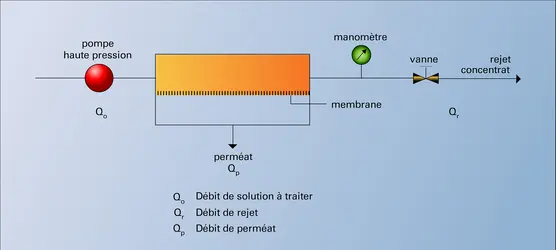
Si, du côté concentré, on oppose une pression hydrostatique égale à la pression osmotique, on peut bloquer le phénomène d'osmose et même l'inverser si la pression appliquée est supérieure à la pression osmotique. On observe alors un passage de solvant pur du côté concentré vers le milieu dilué : c'est l'osmose inverse.
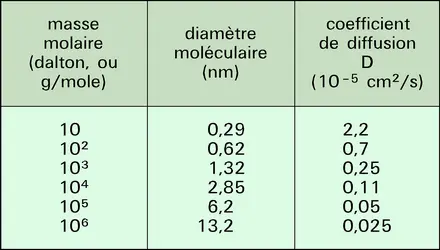
Le flux de solvant obtenu est alors proportionnel à la différence entre la pression appliquée et la pression osmotique : J = A(P — π), A étant la perméabilité de la membrane. Cette perméabilité est indépendante du diamètre des pores et ne dépend que de la solubilité de l'eau dans la membrane. Il est en effet possible de démontrer que :

Les membranes utilisées sont donc obligatoirement[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel RUMEAU : Professeur, Institut des sciences de l'ingénieur de Montpellier (II.S.I.M.), université Montpellier-II (UM2)
Classification
Médias
Autres références
-
ANALYTIQUE CHIMIE
- Écrit par Alain BERTHOD et Jérôme RANDON
- 8 890 mots
- 4 médias
...très souvent nécessaire de séparer les particules solides en suspension dans la phase liquide avant de pouvoir analyser celle-ci. La centrifugation et la séparation par membrane permettent d'atteindre cet objectif. Parmi les possibilités de traitement d'échantillon, les techniques à membrane, qui clarifient... -
CHIMIE - Histoire
- Écrit par Élisabeth GORDON , Jacques GUILLERME et Raymond MAUREL
- 11 189 mots
- 7 médias
Autre secteur concerné par les interfaces : les membranes, micelles et micro-émulsions. -
CHLORE
- Écrit par Henri GUÉRIN
- 5 627 mots
- 5 médias
Depuis le début de la décennie 1970, on tente de remplacer les diaphragmes du type décrit plus haut par desmembranes dites sélectives, ou même échangeuses d'ions. Comme les diaphragmes, ces membranes divisent la cellule en deux espaces, cathodique et anodique, et ne se laissent traverser que par... -
EAU - Approvisionnement et traitement
- Écrit par Georges BREBION , Cyrille GOMELLA et Bernard LEGUBE
- 10 058 mots
- 5 médias
...ci-après, sont aujourd'hui remplacées par les procédés de microfiltration et d'ultrafiltration qui consistent à faire passer l'eau au travers de membranes filtrantes de porosité de l'ordre du micromètre (pour la microfiltration) à quelques centièmes de micromètre (pour l'ultrafiltration), sous...
Voir aussi
- DESSALEMENT
- ÉLECTRODIALYSE
- ÉPURATION, chimie
- FILTRATION, physico-chimie
- IONS
- PRESSION, physique
- CHAMP ÉLECTRIQUE
- ÉPURATION DES EAUX
- POTENTIEL ÉLECTRIQUE
- EAU, physico-chimie
- SOLUTÉ
- MICROFILTRATION
- NANOFILTRATION
- PIÉZODIALYSE
- PERVAPORATION
- ÉQUILIBRE THERMODYNAMIQUE
- DIFFUSION
- ANIONS
- CATIONS
- DIFFUSION GAZEUSE
- PARTAGE COEFFICIENT DE
- SÉPARATION, chimie
- PURIFICATION, physico-chimie
- POTENTIEL CHIMIQUE
- CONCENTRATION, chimie
- ÉLECTRO-OSMOSE
- GAZEUX ÉTAT
- GRAHAM THOMAS (1805-1869)
- PERMÉABILITÉ, chimie physique
- EFFLUENTS CONTRÔLE DES
- HÉMODIALYSE
- AGROALIMENTAIRE TECHNOLOGIE
- KNUDSEN EFFET
- ÉLECTROCINÉTIQUE
- ÉLECTROLYSE
- SOLUTION, chimie
- PRESSION OSMOTIQUE
- OSMOSE, physique
- SÉLECTIVITÉ, chimie
- EAU APPROVISIONNEMENT ET TRAITEMENT DE L'
- POREUX MILIEU
- ULTRAFILTRATION
- COEFFICIENT DE DIFFUSION
- OSMOSE INVERSE
- EAU POTABLE
- CHIMIE PHYSIQUE ou PHYSICO-CHIMIE