MÉTASTASES, médecine
Mécanismes génétiques impliqués dans la métastase
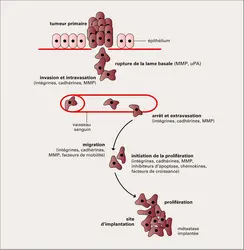
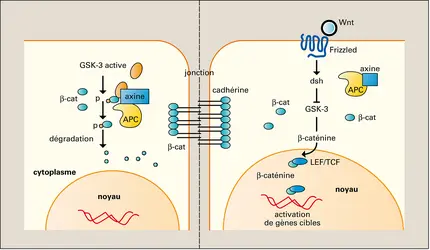
Bien que les tumeurs soient, dans leur grande majorité, clonales, c'est-à-dire issues d'une cellule unique, la population cellulaire tumorale est étonnamment hétérogène. On peut donc envisager la progression tumorale comme l'application, à une cellule normale, de modifications génétiques (mutations) et épigénétiques, capables de produire toute une série de populations variantes qui seront elles-mêmes soumises à des pressions sélectives de la part du microenvironnement, ce qui permettra le développement et la dissémination éventuelle de variants ayant des caractéristiques phénotypiques et biologiques diverses. L'idée communément admise par le passé était que les changements génétiques se produisant dans les cellules durant les premières phases de la progression tumorale donnaient à celles-ci un avantage prolifératif, que ce soit par acquisition de signaux mitogènes constitutifs ou par la capacité de résister à des signaux d'arrêt de croissance ou la faculté d'échapper à la mort cellulaire programmée. Ensuite, certaines de ces cellules à haut potentiel malin, sélectionnées sur la base de leur avantage prolifératif, subiraient d'autres mutations dont certaines, rares, leur conféreraient la capacité de métastaser. Mais ce modèle est mis à mal par le fait que les gènes impliqués dans la dissémination métastatique ne confèrent pas d'avantage prolifératif. Il n'y a donc pas de raison de penser que le phénotype métastatique permet aux cellules concernées d'être progressivement sur-représentées dans la population tumorale, ce qui fait que, dans la masse tumorale, les cellules ayant acquis un pouvoir métastatique resteront très minoritaires. Or, comme nous l'avons signalé, le processus métastatique est par lui-même extraordinairement inefficace, et l'on ne pourrait imaginer, dans ces conditions, comment des métastases seraient à même de se former. Il faut donc considérer un modèle complètement différent dans lequel les mutations conférant un pouvoir métastatique se produiraient très tôt au cours du processus de cancérisation. Les mutations permettant à certaines de ces cellules d'avoir une capacité proliférative accrue se produiraient dans un deuxième temps et permettraient d'accroître, au sein de la population tumorale, les clones cellulaires à fort pouvoir métastatique.
Trois principes découlent de ce raisonnement. Le premier est que la tendance à métastaser est inscrite très tôt dans le patrimoine génétique d'un cancer donné. Le deuxième est qu'il n'existe pas de gènes exclusifs de la cascade métastatique ; ce sont en fait des gènes plus largement impliqués dans la progression tumorale, comme les oncogènes ou les gènes suppresseurs de tumeur. Enfin, étant donné la précocité de l'apparition de mutations pouvant affecter le pouvoir métastatique au cours de la carcinogenèse, même des tumeurs très peu développées peuvent déjà contenir des cellules capables de disséminer. Ce concept est confirmé par un grand nombre d'observations cliniques, en particulier par le fait que l'on a pu trouver des métastases pour des cancers de taille très réduite ou encore le fait que le profil d'expression génique de la population dominante de certains cancers permet de prédire, avec une précision de 90 p. 100, si la tumeur restera localisée ou si le patient risque d'être atteint de métastases.
Ce modèle n'explique pas comment l'ensemble des mutations qui sont requises pour transformer une cellule normale en cellule hautement maligne peuvent se produire en quelques années. En effet, le taux statistique de mutations dans une population cellulaire normale est trop bas pour conduire, en l'espace de quelques dizaines de divisions cellulaires, à un génotype métastatique. Pour[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Brigitte BOYER : directeur de recherche au C.N.R.S.
Classification
Médias
Autres références
-
ASPIRINE ET CANCER
- Écrit par Chantal GUÉNIOT
- 2 074 mots
- 1 média
...patients dans les études. Une deuxième analyse incluant les cinq grands essais conduits en Grande-Bretagne le confirme. Après six ans et demi de suivi, le risque de cancer métastatique était réduit de 36 p. 100 chez les patients traités par aspirine, avec un effet plus marqué pour les cancers de type... -
CANCER - Cancer et santé publique
- Écrit par Maurice TUBIANA
- 14 762 mots
- 8 médias
– La tumeur invasive localisée est née à partir d'une cellule qui de précancéreuse est devenue cancéreuse ; ayant grossi progressivement, elle peut s'infiltrer dans les tissus voisins et dissémine ensuite à distance par voie lymphatique ou sanguine. -
CANCER - Immunothérapie
- Écrit par Emmanuel DONNADIEU
- 5 131 mots
- 5 médias
...lymphocytes T, l’IL2, puis à les réinjecter aux malades. Cette thérapie cellulaire autologue a permis d’obtenir des réponses complètes durables dans des cas de mélanomes métastatiques. Cependant, cette approche nécessite d’avoir accès à la tumeur du patient et de pouvoir isoler puis cultiver ex vivo les lymphocytes... -
CELLULE - Les mouvements
- Écrit par Michel BORNENS et Matthieu PIEL
- 6 583 mots
- 3 médias
...formant des amas, ou lorsqu'on les cultive dans des conditions qui empêchent leur ancrage, conditions qui interdisent la croissance des cellules normales. Cette dérégulation caractérise l'état métastatique des tumeurs : les cellules ne savent plus qu'elles appartiennent à un tissu particulier et migrent... - Afficher les 9 références