MÉTAUX Métaux de transition
Article modifié le
Propriétés chimiques
La chimie des éléments de transition s'avère très riche puisqu'elle englobe la chimie de coordination et la chimie du solide. Très fortement électropositifs, les éléments de transition sont des réducteurs puissants qui réagissent facilement avec la plupart des agents chimiques. Leur oxydation mène à plusieurs stades de stabilité variable, ce qui provoque parfois leur dismutation :

L'oxyde supérieur correspond à un anhydride d'acide si sa charge est supérieure à + 5 (V2O5, CrO3). Les métaux de transition passent en solution, à l'exception des métaux nobles (Au, Pt), sous l'action des acides. En solution basique, l'ion formé s'hydrolyse par suite de son caractère acide ; le stade final est l'hydroxyde M(OH)n insoluble dans l'eau. La tendance à la condensation des anions complexes semble générale ; elle s'accompagne d'un abaissement du pH.
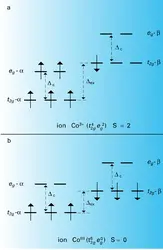
Dans un complexe, à tout ligande peut être substitué un ligande plus fort. La symétrie du complexe dépend de la configuration électronique, un d5 étant souvent tétraédrique, un d8 plan-carré par suite de l' effet Jahn-Teller. Parmi les complexes connus, les métaux cabonyles et les molécules « sandwich » jouent un rôle particulier compte tenu de leurs propriétés.
La chimie du solide des éléments de transition est en pleine expansion. De nombreux composés inédits, stœchiométriques ou non, ont ainsi été mis en évidence, et en particulier les bronzes oxygénés MxTOy où l'élément de transition T se trouve présent avec deux degrés d'oxydation différents avec une proportion qui dépend du taux x en métal M (souvent un alcalin) inséré dans les lacunes du réseau de l'oxyde TOy.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- André CASALOT : maître de conférences à l'université de Provence
Classification
Médias
Autres références
-
ACIDES & BASES
- Écrit par Yves GAUTIER et Pierre SOUCHAY
- 12 367 mots
- 7 médias
Les métaux sont de même attaqués par les sels d'ammonium avec dégagement d'hydrogène :
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES et Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALLIAGES
- Écrit par Jean-Claude GACHON
- 7 363 mots
- 5 médias
Les alliages représentent une illustration matérielle du vieux dicton « l'union fait la force ». L'homme a toujours cherché des matériaux plus performants à l'utilisation, plus faciles à fabriquer ou à mettre en œuvre et plus économiques. Les alliages métalliques sont particulièrement...
-
ALUMINIUM
- Écrit par Robert GADEAU et Robert GUILLOT
- 9 639 mots
- 19 médias
Bien qu'il ne soit passé dans le domaine industriel qu'à la fin du xixe siècle, après la découverte par Paul Louis Toussaint Héroult et Charles Martin Hall du procédé de fabrication par électrolyse, l'aluminium est devenu le premier des métaux non ferreux. Sa légèreté, son inaltérabilité...
- Afficher les 94 références
Voir aussi