MÉTHANE
Article modifié le
Formule brute : CH4
Masse moléculaire : 16,04 g
Masse spécifique : 0,716 8 g/l
Point d'ébullition : — 161,5 0C
Point de fusion : — 184 0C
Le méthane est un hydrocarbure saturé, le plus simple des alcanes. C'est un gaz incolore, d'odeur légèrement alliacée, qui a été découvert en 1778 par A. Volta.
Les quatre liaisons C—H du méthane sont de longueur égale et identiques par leurs propriétés physiques (spectroscopiques, etc.) et chimiques (pas d'attaque préférentielle). Ce fait suggère que l'orbitale 2 s et les trois orbitales 2 p du carbone se combinent pour donner quatre orbitales hybridées sp3 identiques. Le carbone est ainsi au centre d'un tétraèdre.
En présence d'oxygène ou d'air, le méthane détone au contact d'une flamme ; suivant la proportion d'oxygène présent, on peut avoir plusieurs produits de cette réaction d'oxydation : CH4 + 2O2 → CO2 + 2 H2O, et CH4 + O2 → CO + H2 + H2O.
Avec l'oxygène, le méthane s'enflamme à 667 0C, mais en présence de certains métaux, comme le palladium, ce point d'ignition est abaissé, et l'oxydation commence alors à 450 0C. L'oxydation du méthane par la vapeur d'eau se produit entre 800 et 1 000 0C, et elle est réversible : CH4 + H2O ⇆ CO + 3 H2, et CH4 + 2 H2O ⇆ CO2 + 4 H2.
On peut obtenir les produits de substitution d'un ou plusieurs hydrogènes du méthane par des halogènes. La chloruration du méthane en particulier a été très étudiée ; en effet, les quatre dérivés chlorés possibles sont largement utilisés : le chlorure de méthyle (CH3Cl), le chlorure de méthylène (CH2Cl2), le chloroforme (CHCl3), et le tétrachlorure de carbone (CCl4). Cette réaction est influencée par de nombreux facteurs : lumière, température, concentration des réactifs, catalyseurs.
D'autre part, le méthane peut subir une décomposition thermique ou électrique et peut engendrer ainsi, selon les conditions opératoires, de nombreux produits (carbone, hydrogène, acétylène, éthane, éthylène, hydrocarbures aromatiques).
Se formant par fermentation au cours de la décomposition des matières organiques, le méthane est le principal constituant du gaz naturel. Il apparaît au cours des opérations de crackage du pétrole. Il est utilisé comme combustible et comme gaz d'éclairage. Par dissociation thermique et oxydation par la vapeur d'eau, il constitue une source d'hydrogène de plus en plus importante pour l'industrie pétrochimique. C'est le point de départ de nombreuses synthèses de produits organiques, en particulier de l'acide cyanhydrique (et de certains de ses dérivés) et des dérivés chlorés du méthane.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Dina SURDIN : auteur
Classification
Autres références
-
MÉTHANE ET CLIMAT
- Écrit par Hervé HERBIN
- 4 692 mots
- 4 médias
Le méthane (CH4) est présent naturellement dans l’atmosphère terrestre, principalement par le biais d’émissions provenant des environnements pauvres en oxygène tels que les zones humides (marais, tourbières, mangroves, sols inondés) ou les océans. L’élimination du méthane atmosphérique...
-
ACÉTYLÈNE
- Écrit par Henri GUÉRIN
- 5 094 mots
- 6 médias
-
ALCANES
- Écrit par Jacques METZGER
- 3 616 mots
- 11 médias
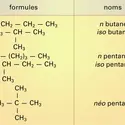
Les quatre premiers termes des alcanes linéaires portent des noms triviaux :méthane, éthane, propane, n-butane. Les suivants sont dénommés systématiquement : C5, pentane ; C6, hexane ; C7, heptane ; C10, décane ; C11, undécane ; C12, dodécane ; C20, éicosane ; C21, hénéicosane... -
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 035 mots
- 5 médias
On séparait simultanément une fraction riche enméthane (le gaz de four à coke en contient environ 25 p. 100) qu'on traitait généralement, pour en extraire de l'hydrogène, par une technique comparable à celle appliquée au gaz naturel. La préparation de l'hydrogène à partir de ce dernier, constitué... -
ATMOSPHÈRE - Chimie
- Écrit par Marcel NICOLET
- 3 554 mots
- 5 médias
On a d'abord reconnu l'existence atmosphérique de la vapeur d'eau, H2O, du méthane, CH4, et de l'hydrogène moléculaire, H2, jusqu'à de hauts niveaux. Dans la mésosphère, on assiste à la photodissociation de H2O et de CH4 par des processus tels que :
- Afficher les 46 références
Voir aussi