MICELLES
Article modifié le
Objets submicroscopiques constitués par l'association de quelques dizaines de molécules, les micelles (du latin mica : grain) se forment, au-dessus d'une certaine concentration, dans les solutions aqueuses de composés divers dits amphiphiles. Les composés amphiphiles sont caractérisés par une structure moléculaire qui comporte une ou des parties hydrophiles (ayant une forte affinité pour l'eau) et une ou des parties lipophiles (ayant une forte affinité pour les huiles, hydrocarbures et autres liquides non polaires) : ce sont les savons et plus généralement les détergents, certains colorants, des composés pharmaceutiques, des substances naturelles et certains polymères.
Les solutions micellaires sont rattachées aux systèmes colloïdaux, et les micelles sont qualifiées de colloïdes d'association. En effet, en solution aqueuse, les molécules d'amphiphiles ne s'associent pour former des micelles qu'au-delà d'une certaine concentration de l'amphiphile, la concentration micellaire critique (C.M.C.). Inversement, la dilution d'une solution micellaire jusqu'à une concentration inférieure à la C.M.C. provoque la désagrégation des micelles. La stabilité thermodynamique des micelles résulte de l'équilibre subtil des interactions mises en jeu entre parties hydrophiles, parties lipophiles et l'eau. Les propriétés des micelles (taille, forme, C.M.C.) ainsi que le mécanisme d'association micellaire sont déterminés par les caractéristiques structurales des parties hydrophiles et lipophiles de l'amphiphile, par sa concentration, par la pression, par la température et par la présence d'additifs divers (sels, alcools, etc.).
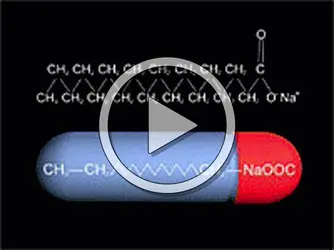
Dans le cas des détergents dont les molécules comportent une partie hydrophile (anionique, cationique, amphotère ou neutre) et une partie lipophile (généralement une chaîne hydrocarbonée linéaire ou ramifiée) bien distinctes, les micelles formées en solution aqueuse diluée sont sphéroïdales avec un diamètre moyen de quelques nanomètres (1 nm = 10—9 m). Les chaînes hydrocarbonées se rassemblent à l'intérieur des micelles, tandis que les parties polaires se situent à leur surface, en contact avec l'eau. L'augmentation de la concentration du détergent se traduit généralement par une croissance de la taille des micelles, qui adoptent progressivement des formes allongées ou aplaties. Les micelles sont des objets dynamiques qui se forment et se désagrègent sans cesse dans la solution. Durant leur temps de vie, elles échangent très rapidement des molécules amphiphiles avec le milieu environnant.
À l'intérieur des micelles, les chaînes hydrocarbonées sont dans un état proche de celui des hydrocarbures liquides. Cela explique la capacité des solutions micellaires à solubiliser diverses substances par ailleurs insolubles dans l'eau (corps gras, hydrocarbures, colorants, etc.). Cette capacité est fortement accrue par l'addition de substances diverses, en particulier certains alcools (par exemple le butanol ou le pentanol). On obtient ainsi des microémulsions huile dans eau.
Certains amphiphiles sont solubles dans les liquides non polaires où ils peuvent s'associer, formant des micelles inverses : les parties hydrophiles constituent maintenant l'intérieur de ces objets tandis que les parties lipophiles sont en contact avec le solvant. Toutefois, en l'absence d'eau, les micelles inverses restent petites et ne comportent que quelques molécules amphiphiles. L'addition de substances diverses exalte la solubilisation de l'eau dans ces systèmes, conduisant ainsi aux microémulsions eau dans huile.
Les applications des solutions micellaires et des microémulsions sont très nombreuses : détergence, lubrification, peinture, métallurgie, pharmacie, industrie pétrolière, industrie chimique (polymérisation en émulsion).
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Raoul ZANA : directeur de recherche au C.N.R.S., Centre de recherches sur les macromolécules, Strasbourg
Classification
Média
Autres références
-
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 506 mots
- 6 médias
...polaires se regroupent en minimisant leur énergie par des interactions de van der Waals tandis que les « têtes » ioniques forment, à l'extérieur de la micelle, une surface solvatée par l'eau. Lorsqu'on introduit un tel savon dans une suspension de gouttelettes d'huile dans de l'eau, les molécules amphiphiles... -
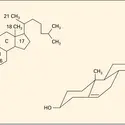
CHOLESTÉROL
- Écrit par Marc PASCAUD et Jacques ROUFFY
- 5 933 mots
- 11 médias
Les gouttelettes (micelles) lipidiques d'origine alimentaire dispersées dans le fluide intestinal, de diamètre de l'ordre de quelques nanomètres (10—9 m), portent en surface les molécules de sels biliaires et de cholestérol associées à des molécules de phospholipides et monoglycérides.... -
COLLOÏDES
- Écrit par Didier ROUX
- 6 011 mots
...hydrophile-lipophile) : c'est une échelle permettant de classifier les tensioactifs non ioniques selon leurs propriétés. Ainsi on a pu caractériser des micelles sphériques, objets de taille finie dont l'interface est très courbée ; des micelles cylindriques dont la longueur peut atteindre plusieurs micromètres,... -
DÉTERGENTS
- Écrit par Louis HO TAN TAÏ et Véronique NARDELLO-RATAJ
- 3 515 mots
- 1 média
Dans l'eau, les molécules de tensioactifs s'associent et forment des agrégats ordonnés appelésmicelles car, dans l'état aggloméré, les parties hydrophobes sont dans une situation énergétique plus favorable et le système est plus stable. La formation des micelles ou micellisation apparaît... - Afficher les 7 références
Voir aussi