MINÉRALOGIE
Article modifié le
Cristallochimie
La cristallochimie peut être définie comme l'étude des relations existant entre la composition chimique d'un solide, l'arrangement géométrique et les forces de liaison entre les atomes constituant le réseau. Ces relations déterminent les propriétés physiques et chimiques. La cristallochimie permet donc de définir les propriétés d'une substance en fonction de sa structure.
Forces de liaison et stéréochimie
On peut définir pour les atomes des volumes d'encombrement, ce qui permet de les représenter par des sphères dont le rayon, de l'ordre de l'angström (0,10 nm), peut être mesuré avec une grande précision par les méthodes radiocristallographiques. Ces rayons atomiques varient avec l'élément, son état d'ionisation, la nature de ses liaisons avec les atomes voisins.
Liaisons atomiques
Dans un cristal, les liaisons et donc les forces par lesquelles s'attirent les atomes peuvent être de différente nature.
Les liaisons métalliques s'exercent entre atomes de métaux électropositifs. Les métaux natifs, de nombreux sulfures et sulfosels possèdent des structures basées sur ces liaisons. Ils peuvent alors être considérés comme formés par un assemblage d'ions positifs, les électrons libérés étant dispersés et se déplaçant facilement au sein de cet assemblage ; pouvant interférer avec les rayons lumineux, ils rendent les métaux opaques et leur donnent leur éclat ; leur mobilité explique les bonnes conductivités thermiques et électriques. La faiblesse des liaisons métalliques et leur facile reconstitution explique la fréquente malléabilité de ces espèces.
Les liaisons covalentes ou homopolaires existent entre les atomes non métalliques de même électronégativité, les atomes voisins mettant en commun leurs électrons de valence en complétant leur couche électronique périphérique. Dans le diamant, par exemple, chaque atome de carbone est entouré par quatre autres atomes de carbone, situés au sommet d'un tétraèdre régulier circonscrit, chacun mettant en commun un électron avec l'atome central, dont la couche électronique de valence se trouve ainsi saturée.
Les liaisons ioniques ou polaires, de nature électrostatique, existent entre ions de charges contraires et obéissent à la loi de Coulomb. Dans ces liaisons, il se produit un transfert d'électron de l'élément électropositif vers l'élément électronégatif, chaque atome acquérant la configuration électronique d'un gaz rare. À l'exception des éléments et sulfures, les liaisons ioniques sont fréquentes dans le règne minéral.
Les liaisons de Van der Waals seraient dues à la résonance des états vibratoires des atomes ; elles existent dans toutes les structures mais leur intensité est très faible par rapport aux autres liaisons. Dans les rares minéraux à réseaux moléculaires (soufre, réalgar AsS2, calomel HgCl2, sénarmontite Sb2O3), les liaisons intramoléculaires, covalentes, sont fortes, alors que les molécules sont faiblement liées entre elles par des forces de Van der Waals.
Des liaisons de types différents coexistent souvent dans les minéraux ; dans ce cas, les propriétés physiques comme la dureté, le point de fusion, la résistance mécanique sont fonction des liaisons les plus faibles, qui cèdent en premier.
Dans certaines structures ioniques, il y a apparition d'ensembles individualisés : radicaux simples, tels que (CO3)2-, (SO4)2-, (PO4)3-, ou polymérisés (structures des silicates, des borates).
Nombre de coordination
On appelle nombre de coordination ou, plus simplement, coordinence d'un atome, le nombre total d'atomes, de radicaux ou de molécules unis à cet atome central (cf. composés de coordination).
Dans un cristal ionique, les ions de petite taille, cations en général, s'entourent du nombre maximum de gros ions, anions en général, et ce nombre est fonction des tailles relatives de ces ions ; de plus, comme il est nécessaire que l'assemblage soit électriquement stable, donc neutre, la somme des charges électriques s'équilibre exactement.
Quand le terme « coordinence » est utilisé sans être précisé, c'est que l'on se réfère à la coordinence par rapport à l'oxygène, élément de loin prédominant dans la croûte terrestre (46,6 p. 100 en poids et 92 p. 100 en volume) et dont l'arrangement détermine une grande partie des structures minérales.
La coordinence varie en fonction du rapport entre les rayons des ions considérés.
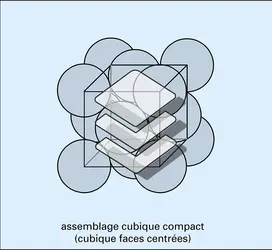
Un assemblage compact peut être soit hexagonal compact, soit cubique compact (cubique à faces centrées).
Dans les structures ioniques, les coordinences 5, 7, 9, 10 et 11 sont rares. La plupart des cations ont une seule coordinence par rapport à l'oxygène ; d'autres comme Al, Ca, Na, Zn, etc. en ont deux, car le rapport de leur rayon au rayon de l'oxygène est proche de la limite séparant deux domaines de coordinence. Pour l'aluminium, ce rapport (0,43) est proche de la limite entre les coordinences 4 et 6. Cette double coordinence conditionne la structure et l'existence de très nombreux silicates ; en effet, la coordinence dépendra en partie de la température et de la pression à laquelle a lieu la cristallisation (une élévation de température et une diminution de pression favorisent une faible coordinence).
En général, les coordinences ne sont pas exprimées dans les formules chimiques des minéraux, sauf pour différencier certains polymorphes. Par exemple, andalousite, disthène et sillimanite ont pour formule Al2SiO5, mais les atomes d'aluminium ont des coordinences différentes précisées en exposants : andalousite, AlVIAlV [O|SiO4] ; disthène, AlVI2 [O|SiO4] ; sillimanite, AlVI AlIV [O|SiO4].
Valence électrostatique
Les composés ioniques devant être électriquement neutres, si la charge d'un cation est Z et le nombre d'anions l'entourant n, la force de liaison ionique entre le cation et un de ces anions est Z/n : c'est la valence électrostatique de la liaison. Les structures dans lesquelles toutes les liaisons sont de force égale sont appelées isodesmiques. Dans les cristaux anisodesmiques, les anions auront des liaisons plus fortes avec le cation central qu'avec les autres atomes, d'où l'apparition d'un radical : carbonates, sulfates, etc. Enfin dans les structures mésodesmiques – cas des silicates –, la valence électrostatique égale la moitié de la valence chimique de l'anion.
Il faut bien distinguer valence chimique et valence électrostatique : le nombre des anions entourant un cation est déterminé par la valence électrostatique, dépendant de la coordinence, et non par la valence chimique. Cela explique que certains composés ne puissent exister dans la nature bien qu'ils aient des formules théoriques compatibles avec les règles de valence chimique.
Énergie réticulaire
L'énergie réticulaire d'un cristal ionique est l'énergie nécessaire pour disperser en ions séparés une masse de ce cristal correspondant à une mole. Cette énergie sera d'autant plus grande que la charge des ions est plus forte, que les ions sont plus petits et que l'assemblage est plus compact.
D'une façon générale, l'ordre de cristallisation des minéraux dans une roche suit plus ou moins régulièrement la décroissance de l'énergie réticulaire de leurs réseaux. De plus, à une diminution de l'énergie réticulaire correspond une diminution de la dureté, une augmentation de la solubilité, un accroissement des distances interréticulaires.
Formule chimique des minéraux
Pour définir une espèce minérale, il est nécessaire d'en connaître la composition chimique. Pour cela, après une analyse qualitative complète, on effectuera, par diverses méthodes physico-chimiques, une analyse quantitative qui donnera les proportions relatives des éléments constituants et permettra ensuite d'en tirer une formule qui indique les éléments présents et en quelles proportions ils se trouvent (cf. chimie analytique).
Les analyses quantitatives sont souvent fort malaisées, la plupart devant être réalisées sur des minéraux difficiles à trier et de composition parfois très complexe. Ce n'est que relativement depuis peu de temps que la formule de nombreux silicates est bien connue, surtout grâce aux progrès réalisés dans la connaissance de leur structure.
Expression et interprétation des analyses
On exprime habituellement les analyses en pourcentage en poids d'éléments, d'anhydrides ou d'oxydes pour les minéraux oxygénés ; en effet, l'oxygène n'est pratiquement jamais déterminé directement.
Lorsqu'un minéral oxydé contient des éléments non métalliques autres que l'oxygène (halogènes, soufre, etc.), la somme des pourcentages en poids qui doit être voisine de 100 (99,5 à 100,5 pour une macroanalyse correcte) pourra nettement dépasser ce chiffre ; en effet, de l'oxygène a été indûment compté en quantité équivalente à celle nécessaire pour saturer les atomes métalliques combinés au soufre ou aux halogènes. Il faudra donc retrancher le poids de l'oxygène en excès.
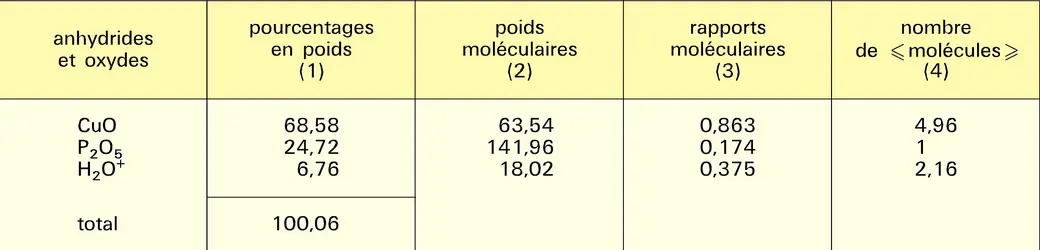
On peut prendre quelques exemples de calculs permettant d'établir la formule d'un minéral à partir de son analyse, comme celle qui figure au tableau. Les rapports moléculaires sont obtenus en divisant le pourcentage en poids par le poids moléculaire des oxydes ou anhydrides. Les rapports moléculaires sont entre eux comme les nombres de molécules d'oxydes contenus dans le minéral : pour 174 molécules de P2O5 on aura 863 molécules de CuO (en réalité, il n'existe pas de molécules d'oxydes ou d'anhydrides, mais c'est une façon conventionnelle d'exprimer l'oxygène non dosé). En considérant la colonne 3 et en prenant comme égal à 1 le plus grand commun diviseur, soit 0,174, on obtient en 4 le nombre de « molécules » d'oxydes ou d'anhydrides constituant la formule, soit 4,96 CuO, P2O5, 2,16 H2O ; pour obtenir une formule stœchiométrique tenant compte de la loi de Dalton, on ramènera les exposants à des nombres entiers, soit : 5 CuO, P2O5, 2 H2O (pseudo-malachite). Mais, actuellement, les formules ne sont plus données sous forme dualistique mais structurale ; ces formules structurales indiquant à la fois les relations structurales des atomes entre eux et les remplacements possibles dans ces structures ; on aura donc Cu5(PO4)2, et les quatre valences positives restantes saturées par 4 hydroxyles, soit Cu5(PO4)2(OH)4.
L'eau pose souvent un problème dans les analyses ; elle peut exister sous forme adsorbée (humidité), ou sous forme d'eau de cristallisation, ou encore être formée à partir d'hydroxyles, d'ions hydrogène ou hydroxonium (H3O)+ existant dans la structure. Il faut donc établir sous quelle forme elle se trouve par des méthodes annexes (analyse thermique, spectrographie infrarouge, etc.). Par convention, on désigne par H2O+ l'eau de constitution et par H2O- l'eau d'adsorption, éliminée par chauffage à 110 0C et dont on ne tiendra pas compte dans les calculs analytiques et la formule.
Utilisation des formules structurales
Dans les minéraux, on l'a vu, la structure est pratiquement déterminée par l'arrangement des gros ions, anions en général, et pour les composés oxygénés par celui des ions oxygène ; si les méthodes radiocristallographiques ont permis de déterminer dans quel groupe de structure connue se situe le minéral, par exemple pyroxène ou grenat, il est possible de calculer l'analyse sur la base du nombre d'atomes d'oxygène déterminant la maille et donc d'obtenir des formules structuralement plus exactes.
Utilisation des paramètres de la maille
On calcule le volume V de la maille en nm3 à partir des paramètres en nm. La densité mesurée étant d, le poids P du contenu de la maille élémentaire est égal à V × d (P en grammes = V.d.10-24). Rappelons que la maille contient un nombre Z de « formules-unités » correspondant à la formule chimique usuelle. Le poids d'une « formule-unité » est égal au quotient de la masse atomique ou moléculaire M de la formule chimique usuelle par N (0,602 3.10 24). Le nombre Z se trouve donc égal à :



Détermination du nombre d'atomes dans la maille
Soit, pour une analyse de minéral, Σ la somme des pourcentages en poids des éléments, oxydes, anhydrides du résultat analytique, en ne tenant pas compte de l'eau d'adsorption, Q le pourcentage par rapport à Σ d'un élément de masse atomique m, R = Q/m le rapport atomique de cet élément, d la densité mesurée, V le volume de la maille en nm3, et V.d.10-24 le poids P en grammes du contenu de la maille. Le nombre z d'atomes de l'élément considéré dans la maille est donné par :

Les phénomènes de remplacement dans les minéraux
Les résultats analytiques montrent que les espèces minérales ont rarement leur composition idéale. Les écarts constatés, souvent dus à des impuretés dans la prise d'essai, peuvent aussi résulter de substitutions dans les réseaux. Les minéralogistes utilisent des formules indiquant les variations de la composition chimique, formules dans lesquelles tous les composants chimiques structuralement équivalents sont regroupés. Par exemple, l'almandin, le plus courant des grenats, a pour formule idéale :


Deux espèces seront isostructurales si elles ont même formule chimique globale, même groupe de symétrie, mêmes coordinences des atomes les constituant. Deux espèces seront isomorphes si elles sont isostructurales et si les rapports des rayons cationiques et anioniques des éléments les constituant sont assez proches pour que les deux espèces puissent plus ou moins complètement syncristalliser en donnant des cristaux de composition mixte. Les cristaux mixtes résultant de la syncristallisation de composés isomorphes ou non sont appelés solutions solides. Un terme de la série de solutions solides existant entre forstérite et fayalite (péridots) peut être considéré comme une solution homogène de Mg2[SiO4]dans Fe2[SiO4](olivine) ; en réalité, il y a remplacement statistique dans le réseau d'ions Fe2+ par des ions Mg2+. On appelle éléments diadochiques ceux qui peuvent se substituer les uns aux autres pour occuper de mêmes positions réticulaires dans un cristal. Dans la série forstérite-fayalite, Mg2+ et Fe2+ sont diadochiques. Les solutions solides peuvent former une série complète ou partielle entre les termes extrêmes.
On distingue trois types de solutions solides.
Dans les solutions solides de substitution, les atomes sont substitués diadochiquement ; pour cela il faut que l'atome substitué satisfasse à plusieurs conditions, et en particulier pour les cristaux ioniques :
– Les atomes ou ions peuvent se remplacer s'il n'y a pas plus de 15 p. 100 de différence entre leurs rayons ioniques pour une même coordinence. Par exemple, Cu2+ (r = 0,072 nm) et Zn2+ (r = 0,074 nm) pourront se remplacer facilement ; au contraire Ca2+ (r = 0,092 nm) et Mg2+ (r = 0,066 nm) n'auront que peu de possibilités de substitution bien que leurs propriétés chimiques présentent de nettes analogies.
– Normalement un ion ne peut être remplacé que par un ion de même électrovalence, mais il peut y avoir substitutions multiples avec compensation électrostatique. La plus connue existe dans les feldspaths plagioclases, entre l'albite Na[AlSi3O8]et l'anorthite Ca[Al2Si2O8], le remplacement de Na+ par Ca2+ étant compensé par celui de Si4+ par Al3+ (cf. feldspaths).
– En général, les possibilités des substitutions augmentent avec la température de formation. Ainsi, à haute température (> 700 0C), le sodium et le potassium sont totalement interchangeables dans la structure des feldspaths. Lorsque la température retombera, la solution solide deviendra instable, il y aura précipitation d'un autre composé : exsolution. Le feldspath sodipotassique de haute température donnera par exsolution des associations orientées d'albite et de feldspath potassique K[AlSi3O8], connues sous le nom de perthites. La température d'exsolution donne ainsi une limite inférieure de température de formation de l'association étudiée ( thermomètre géologique).
Dans le cas des solutions solides d'addition, les atomes substitués occupent des positions interstitielles dans le réseau de l'hôte. Ces solutions solides sont fréquentes dans les phyllosilicates et tectosilicates : minéraux des argiles et zéolites.
Les solutions solides de soustraction constituent le dernier type. Dans la pyrrhotine, Fe1-xS, les analyses montrent toujours un excès de soufre qui est dû à l'absence de certains atomes de fer dans le réseau, mais, pour assurer la nécessaire compensation électrostatique, certains atomes de fer du réseau deviennent trivalents.
Le problème des éléments en traces
La plupart des analyses de minéraux montrent la présence de nombreux éléments en traces (teneur inférieure à 1 p. 100). Depuis le développement de la géochimie, on considérait que ces éléments en traces résultaient le plus souvent de substitutions diadochiques. Des études, permises surtout par l'emploi de la microsonde électronique, réalisant des analyses ponctuelles sur des échantillons homogènes, à l'échelle des quelques micromètres cubes de volume intéressé (cf. infra, Méthodes quantitatives), ont montré que les substitutions diadochiques sont rares en dehors des solutions solides classiques. Ce sont plutôt les défauts, les microfissures, les inclusions qui régissent la présence des « éléments en traces », qui sont en réalité fréquemment des « éléments fissuraux », situés en dehors du réseau du minéral hôte. Il convient donc maintenant de préciser par des méthodes annexes la forme cristallochimique d'un élément avant de considérer qu'il est substitué diadochiquement.
Polymorphisme
Plusieurs espèces minérales sont polymorphes si elles ont même formule chimique, mais des structures différentes ; pour un élément on emploie le terme d'allotrope : par exemple, diamant et graphite sont deux formes allotropiques du carbone ; aragonite et calcite sont deux espèces polymorphes du carbonate de calcium CaCO3.
Les différents polymorphes d'une même substance sont formés sous différentes conditions de température, de pression, d'environnement chimique ; donc la présence d'un polymorphe dans une roche renseigne sur les conditions de formation de cette roche. Si les conditions changent, il peut y avoir réarrangement du réseau et passage d'un polymorphe à un autre : transition. Le point de transition pour une pression donnée correspond à la température d'équilibre des deux phases. Toutes les transitions sont réversibles, mais il peut y avoir des retards au changement d'état qui peuvent se chiffrer en millions d'années ou ne pas être décelables pour des températures ordinaires. Les vitesses de transformation d'une espèce polymorphe en une autre sont très variables et dépendent du degré de reconstitution de la structure : si la transition correspond à une simple déformation du réseau, elle est pratiquement immédiate à la température du point de transition (transition du quartz β de haute température, hexagonal, en quartz α de basse température à 573 0C).
On peut considérer, par contre, des transitions comme pratiquement irréversibles, car demandant de fortes dépenses d'énergie pour détruire l'ancienne structure et en reconstruire une nouvelle (transition graphite ⇌ diamant).
Pseudomorphoses
Un minéral peut en remplacer un autre en en conservant la forme extérieure ; c'est une « pseudomorphose « : par exemple, un octaèdre de cuprite Cu2O peut se transformer plus ou moins complètement en malachite Cu2CO3(OH)2 ; la pyrite FeS2 peut se transformer en goethite FeO(OH). Les pseudomorphoses peuvent aussi résulter d'incrustation plus ou moins prononcée d'un minéral par un autre : quartz pseudomorphosant la fluorine, calcification des sources incrustantes. Enfin un minéral inclus dans une roche peut disparaître, laissant une cavité correspondant à son faciès cristallin, cavité qui peut être remplie par un autre minéral, cas fréquent de pseudomorphose de sel gemme en calcite.
Minéraux amorphes
La spécificité des minéraux amorphes est souvent mise en question ; en effet leur composition chimique est mal définie et ils ne sont que peu structurés. Les minéraux amorphes comprennent les verres, les gels et les minéraux métamictes.
Verres et gels
On connaît des verres de silice (90 à 99 p. 100 de SiO2) appelés lechatelierites ; ils forment en particulier les fulgurites, tubes de longueur variable (quelques décimètres à quelques mètres), produits de fusion par la foudre du sable des plages ou des déserts ; ces verres existent aussi dans certains cratères d'impacts météoritiques.
Les gels proviennent de la solidification de solutions colloïdales. L'opale, gel de silice hydratée, est le plus commun ; on connaît des gels de sulfure (métastibnite : sulfure d'antimoine), d'oxydes (limonite, gummite), de phosphates (diadochite : phosphate de fer), de silicates (allophanes, chrysocolle).
Minéraux métamictes
Les minéraux métamictes sont optiquement isotropes et amorphes aux rayons X, d'éclat vitreux ou résineux ; sans clivage, ils ont une cassure conchoïdale. Ils sont toujours radioactifs, et c'est la radioactivité α de l'uranium ou du thorium qu'ils contiennent qui a provoqué la destruction de leur réseau cristallin. Cette métamictisation est plus ou moins complète ; par chauffage, ils peuvent recristalliser en émettant de la chaleur. On citera : gadolinite Y2Βe2Fe [OSiO4]2, thorite Th[SiO4], fergusonite YNbO4, euxénite (niobotantalotitanate de terres rares, avec uranium).
Accédez à l'intégralité de nos articles
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Claude GUILLEMIN : correspondant de l'Institut, inspecteur général honoraire du Bureau de recherches géologiques et minières à Orléans
Classification
Médias
Autres références
-
AGRICOLA GEORG BAUER dit (1494-1555)
- Écrit par Jean-Pierre MENDIBURU
- 267 mots
Érudit allemand né à Glauchau (Saxe), Agricola peut être considéré comme le père de la minéralogie. Après des études de philosophie à Leipzig, à Bologne et à Padoue, des études de médecine à Ferrare, il exerce comme médecin municipal à Joachimstal de 1527 à 1533, puis à Chemnitz de 1533...
-
ASTÉROÏDES
- Écrit par Christiane FROESCHLÉ , Claude FROESCHLÉ et Patrick MICHEL
- 10 702 mots
- 13 médias
...est différent (0,03 en moyenne pour la classe C ; entre 0,10 et 0,22 pour la classe S) ainsi que la forme du spectre. Les astéroïdes de type C ont une composition minéralogique identique à celle des météorites dites chondrites carbonées, tandis que ceux du type S sont analogues aux météorites riches... -
BECKE FRIEDRICH (1855-1931)
- Écrit par Myriam COHEN
- 153 mots
Minéralogiste et pétrographe autrichien, F. Becke a grandement participé à la mise en place et au développement des méthodes optiques en pétrographie.
Né à Prague, il fit ses études à Vienne, où il obtint la chaire de minéralogie de l'université en 1898 ; il en devint recteur en 1921....
-
CHAPEAUX OXYDÉS
- Écrit par Guy TAMAIN
- 983 mots
Initialement, le mineur désignait par chapeaux de fer les masses de limonites formées par altération des gisements renfermant de la pyrite et/ou d'autres sulfures de fer. Puis, par extension, on parle de chapeaux de fer des gisements métalliques sulfurés, c'est-à-dire la zone où s'effectue...
- Afficher les 36 références
Voir aussi
- GALÈNE (sulfure de plomb)
- COORDINENCE ou NOMBRE DE COORDINATION
- DIADOCHIE
- ISOMORPHISME, physique du solide
- ORTHOSE ou ORTHOCLASE
- SMITHSONITE
- CÉRUSITE
- MACLES
- DENSITÉ
- CRISTALLOGRAPHIE
- ARSENIATES NATURELS
- HALOGÉNURES NATURELS
- CHROMATES NATURELS
- TUNGSTATES NATURELS
- NITRATES NATURELS
- MOLYBDATES NATURELS
- COLÉMANITE
- BORATES NATURELS
- FLUORINE ou FLUORITE ou SPATH FLUOR
- CRYOLITHE
- AMBLYGONITE
- ÉRYTHRITE ou ÉRYTHRINE, minéralogie
- CRISTALLOCHIMIE
- KERNITE
- POLYMORPHISME, physique du solide
- SOLUTIONS SOLIDES
- MAILLE, cristallographie
- FACIÈS CRISTALLIN ou FORME DES CRISTAUX
- CLIVAGE
- CALCITE
- ARAGONITE
- HALITE
- CHALCOPYRITE
- CASTAING MICROSONDE DE
- MOHS DURETÉ
- MONAZITE
- SPODUMÈNE ou TRIPHANE
- SALPÊTRE (nitrate de potassium)
- MINÉRAUX
- BIOTITE
- PARAGENÈSES MINÉRALES
- GELS, minéralogie
- PLÉOCHROÏSME
- PHOSPHATES NATURELS
- PERTHITES
- SCORODITE
- XÉNOMORPHE MINÉRAL
- MÉTAMICTES MINÉRAUX
- TÉTRAÉDRITE
- PROUSTITE
- POLYSYNTHÉTIQUE CRISTAL
- VANADATES NATURELS
- MOHS FRIEDRICH (1773-1839)
- PYRRHOTINE ou PYRRHOTITE
- PSEUDOMORPHOSE
- ASSEMBLAGE COMPACT
- EXSOLUTION
- AMORPHES MINÉRAUX
- AUTOMORPHE MINÉRAL
- DURETÉ ÉCHELLE DE
- FIBROLITE
- ARSÉNOPYRITE ou MISPICKEL
- CUPRITE
- FRANCEVILLITE
- AUTUNITE
- DESCLOÏZITE
- BORAX
- CINABRE (sulfure de mercure)
- AGRÉGATS CRISTALLINS
- ÉCLAT, minéralogie
- CLASSIFICATION, minéralogie
- TRANSPARENCE
- MINÉRAUX ORGANIQUES
- MELLITE
- WHEWELLITE
- ALUNITE
- CROCOÏTE
- SCHEELITE
- OLIVÉNITE
- MIMÉTITE
- PHARMACOLITE
- VIVIANITE
- WAVELLITE
- PYROMORPHITE
- BROCHANTITE
- MINÉRAUX IDENTIFICATION DES
- GÉOLOGIE HISTOIRE DE LA