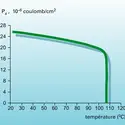
DIPOLAIRES MOMENTS
Utilisation des moments dipolaires
On ne reviendra pas sur les informations fournies par cette grandeur dans l'étude des structures moléculaires. Mentionnons d'autres travaux utilisant cette caractéristique moléculaire.
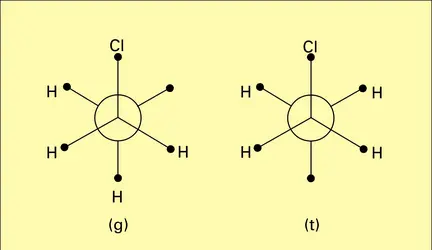
Tout d'abord, on s'est limité à des molécules de moment bien défini ; mais toute déformation, une rotation gênée par exemple, se traduit par une valeur apparente du moment, variable avec la température de mesure. L'analyse est particulièrement simple dans le cas du dichloroéthane, qu'on peut interpréter comme résultant de l'équilibre de deux rotamères, dont l'un possède un moment nul, ce qui permet le calcul du moment moyen apparent à partir de la forme polaire, compte tenu du poids statistique de chaque forme, soit :

Une méthode d'étude des associations en solvants non ionisables peut également se déduire des relations précédentes. La relation de Clausius-Mossotti se généralise sans difficulté au cas de mélanges et permet de mettre en évidence des associations dont le moment est le plus souvent supérieur à celui des constituants. Cette méthode, limitée à des solutions diluées, peut être étendue à des solutions concentrées en généralisant la relation (7) de Onsager au cas d'un mélange de constituants polaires.
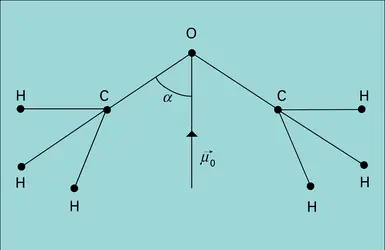
Une des associations en phase liquide les plus fréquentes est constituée par la liaison hydrogène, dont le moment important (∼ 3 D) peut être interprété par la contribution d'une forme mésomère ionique A−H---B ↔ (A−H)-B+. La valeur considérable de ce moment confère une permittivité élevée aux liquides associés tels que l'eau, les alcools ou l'acide cyanhydrique. Sans aucun doute, l'accumulation de telles liaisons dans de nombreux composés d'intérêt biologique doit jouer un grand rôle. Ce domaine est encore peu exploré, et on se contentera de citer l'exemple d'un polymère synthétique, le poly-L-γ glutamate de benzoyle. Sa structure en hélice α droite est stabilisée par des liaisons N−H---O = C dont les moments concordants déterminent une valeur du moment résultant proportionnelle à la longueur de l'hélice et, de ce fait, particulièrement élevée.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean BARRIOL : Correspondant de l'Institut. Professeur émérite à l'Université Nancy
Classification
Médias
Autres références
-
DEBYE PETER JOSEPH WILLEM (1884-1966)
- Écrit par P. M. HEIMANN
- 1 237 mots
...sont inégalement distribués parmi les atomes dans les molécules, de sorte que celles-ci peuvent être considérées comme des dipôles électriques permanents. Debye put expliciter la liaison entre structure moléculaire et moment dipolaire (produit de la charge par la distance constante entre les pôles). -
FERRO-ÉLECTRICITÉ
- Écrit par Lucien GODEFROY
- 2 836 mots
- 3 médias
Les corps ferro-électriques sont une classe de diélectriques solides, dont l'étude s'est développée depuis 1945. L'intérêt de ces matériaux n'est pas seulement théorique ; leur très grande constante diélectrique, leurs propriétés non linéaires, tant électriques qu'optiques, sont exploitées dans de...
-
INTERACTIONS (physique) - Électromagnétisme
- Écrit par Bernard DIU
- 4 448 mots
- 6 médias
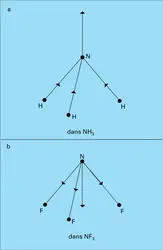
Deux charges opposées localisées en des points distincts constituent un dipôle électrique.Les molécules d'eau H2O et d'ammoniac NH3 sont ainsi dipolaires : les électrons qui assurent dans ces molécules les liaisons covalentes sont (partiellement) repoussés par les H, « électropositifs... -
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 250 mots
- 7 médias
Le centre de gravité des électrons ne coïncidant alors plus avec celui des noyaux positifs, la liaison possède un moment dipolaire. Les moments des diverses liaisons se composent géométriquement pour donner le moment dipolaire total de la molécule. - Afficher les 9 références