- 1. L'apoptose : mort cellulaire de type 1
- 2. La mort cellulaire autophagique : mort cellulaire de type 2
- 3. La nécrose : mort cellulaire de type 3
- 4. Diversité des types de morts cellulaires
- 5. Implications physiologiques et physiopathologiques de la mort cellulaire
- 6. Bibliographie
- 7. Sites internet
MORTS CELLULAIRES
La nécrose : mort cellulaire de type 3
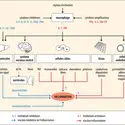
Initialement employé par les pathologistes pour révéler la présence de cellules ou de tissus morts, le terme nécrose (du grec nekros, pour désigner un cadavre) a longtemps été utilisé pour définir, par défaut, un processus de mort cellulaire survenant de façon accidentelle et qui ne présente pas les modifications morphologiques caractéristiques de l'apoptose (telles la pycnose, la caryorrhexis, la fragmentation de leur cytoplasme et la formation de corps apoptotiques) et de l'autophagie.
Les caractéristiques de la nécrose cellulaire
Les principales modifications morphologiques observées lors de la mort cellulaire nécrotique sont l'augmentation du volume cellulaire, également appelée oncose (du grec onkos, « dilatation »), un gonflement des organites et une accentuation de la perméabilité de la membrane plasmique des cellules mourantes. Ces phénomènes contribuent à la rupture de la membrane plasmique de ces cellules et à la libération dans le milieu environnant de leur contenu cellulaire, ce qui déclenche une forte réaction inflammatoire. Longtemps considérée comme une mort cellulaire accidentelle, non contrôlée et déclenchée par des stress non spécifiques et non physiologiques, la mort cellulaire nécrotique peut cependant présenter, dans certaines conditions expérimentales, des modifications biochimiques habituellement détectées lors de processus cellulaires programmés. Dans ce contexte, les cellules nécrotiques révèlent un dysfonctionnement mitochondrial (détectable par la perméabilisation de la membrane des mitochondries, l'augmentation importante de la production de radicaux libres oxydatifs et la déplétion intracellulaire en ATP), des altérations lysosomales et nucléaires (révélées par la perméabilisation des lysosomes et l'hyperactivation de la protéine PARP-1), une dégradation des lipides cellulaires consécutives à l'activation de phospholipases, de lipoxygénases et de sphingomyélinases. De plus, l'importante augmentation du calcium dans le cytosol, observable lors de la nécrose, peut aussi provoquer des altérations mitochondriales et être responsable de l'importante protéolyse consécutive à l'activation de calpaïnes (une famille de protéases à cystéine dépendantes du calcium) et de protéases lysosomales (telles que les cathepsines). L'inhibition pharmacologique ou génétique de ces enzymes et des mécanismes responsables de leur(s) activation(s) empêche le développement d'une mort cellulaire nécrotique et démontre leur(s) participation(s) active(s) dans l'exécution de la nécrose.
L'exécution programmée de la nécrose
L'identification de voies de signalisation spécifiques associées à la nécrose ainsi que l'existence de mécanismes génétiques et épigénétiques capables de la réguler mettent en évidence la survenue et l'exécution programmées de la nécrose. Identifiée lors de l'activation de récepteurs de mort – comme le récepteur du facteur nécrosant des tumeurs de type 1 (TNFR1) et Fas/CD95 – en présence d'inhibiteurs pharmacologiques des caspases, la kinase RIP-1 (receptor interacting protein-1) est une des premières protéines possédant une activité biologique pro-nécrotique à avoir été identifiée. Cette protéine RIP-1 contrôle également la PMM en inhibant l'activité enzymatique du translocateur de nucléotides à adénine (ANT), ce qui provoque une accumulation pro-nécrotique de céramide et déclenche la mort cellulaire nécrotique. L'activité biologique de cette protéine peut être inhibée par une petite molécule appartenant à une nouvelle classe d'agents cytoprotecteurs, la nécrostatine-1. La combinaison d'approches de biologie systémique et d'analyses in silico des voies de signalisation cellulaire, initiées lors de processus[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Luc PERFETTINI : docteur en immunologie, chargé de recherche à l'Institut national de la santé et de la recherche médicale (NSERM), Villejuif
Classification
Autres références
-
RÉACTION INFLAMMATOIRE
- Écrit par Jean-Marc CAVAILLON
- 4 573 mots
- 5 médias
...cellules font-elles la différence entre des cellules saines et des cellules lésées ? Lorsque les tissus subissent une altération de leur intégrité associée à la mort de cellules, ces dernières libèrent des molécules que l’on appelle signaux de danger ou damage associatedmolecular patterns (DAMPs, «...