- 1. L'apoptose : mort cellulaire de type 1
- 2. La mort cellulaire autophagique : mort cellulaire de type 2
- 3. La nécrose : mort cellulaire de type 3
- 4. Diversité des types de morts cellulaires
- 5. Implications physiologiques et physiopathologiques de la mort cellulaire
- 6. Bibliographie
- 7. Sites internet
MORTS CELLULAIRES
Implications physiologiques et physiopathologiques de la mort cellulaire
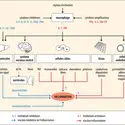
La mort cellulaire participe à de nombreux processus physiologiques et contribue au développement et à l'établissement de désordres pathologiques. L'apoptose, l'autophagie et la nécrose participent au développement embryonnaire et postembryonnaire ainsi qu'à la morphogenèse de nombreux organismes vivants. De plus, comme l'apoptose, l'autophagie est impliquée dans l'homéostasie cellulaire et tissulaire des organismes adultes en contrôlant la prodigalité de la mitose. Cent mille cellules sont produites chaque seconde par mitose dans l'organisme humain et un nombre similaire de cellules meurent par apoptose afin de garantir l'homéostasie cellulaire et tissulaire. L'autophagie permet aussi à une cellule de s'adapter à différentes situations de stress physiologiques et pathologiques en protégeant l'organisme contre les désordres neurodégénératifs, le vieillissement et les maladies cardiaques. La dégradation lysosomale impliquée lors de l'autophagie contribue également à la survie et à la différentiation cellulaire. La nécrose peut également survenir au cours du développement de l'organisme (en déclenchant la mort des chondrocytes lors de la croissance longitudinale des os) et dans l'homéostasie tissulaire (concernant notamment les cellules épithéliales intestinales ou le nombre et l'activité des cellules du système immunitaire).
De plus, les trois types principaux de mort cellulaire sont également des stratégies cellulaires défensives de l'organisme, destinées à empêcher l'établissement d'une infection ou à éliminer sélectivement les cellules infectées, endommagées ou mutées. Le dysfonctionnement de ces processus létaux contribue au déclenchement et/ou à la progression de nombreuses pathologies humaines. Une apoptose aiguë massive favorise l'émergence de maladies neurodégénératives chroniques et d'infections comme celle que déclenche le virus de l'immunodéficience humaine aboutissant au développement du syndrome d'immunodéficience acquise (sida). Une dérégulation de l'autophagie – essentiellement observée au niveau de cellules qui ne prolifèrent pas, comme les cellules musculaires et les cellules neuronales – peut aboutir à une accumulation de vacuoles autophagiques observables lors de désordres neurodégénératifs, tels que les maladies de Parkinson, de Huntington et d'Alzheimer ainsi qu'au cours de scléroses latérales amyotrophiques. À l'inverse, une inhibition de l'autophagie peut contribuer à la croissance de lésions cellulaires précancéreuses. La résistance des cellules à une mort par apoptose ou par autophagie peut également aboutir au développement et à la progression de maladies humaines comme le cancer.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jean-Luc PERFETTINI : docteur en immunologie, chargé de recherche à l'Institut national de la santé et de la recherche médicale (NSERM), Villejuif
Classification
Autres références
-
RÉACTION INFLAMMATOIRE
- Écrit par Jean-Marc CAVAILLON
- 4 573 mots
- 5 médias
...cellules font-elles la différence entre des cellules saines et des cellules lésées ? Lorsque les tissus subissent une altération de leur intégrité associée à la mort de cellules, ces dernières libèrent des molécules que l’on appelle signaux de danger ou damage associatedmolecular patterns (DAMPs, «...